ТОП-5 промышленно-значимых самых тугоплавких металлов
Самый тугоплавкий металл: разбор понятия тугоплавкости + общие физические свойства элементов + 3 методики получения тугоплавких металлов + 7 популярных сфер применения + рейтинг тугоплавкости металлов.

В промышленности термин «тугоплавкий металл» весьма распространен. Благодаря физическим свойствам, группу веществ металлического типа ценят во всех металлургийных отраслях.
Да что там говорить, без открытия самого тугоплавкого металла наш мир не увидел бы лампочку в ее классическом виде еще десятки лет. В сегодняшней статье будут рассмотрены особенности тугоплавких металлов, их физические/химические свойства + области применения в различных областях промышленности и не только.
- 1 Что такое тугоплавкость металлов?
- 2 Самый тугоплавкий металл: 5 элементов группы + добыча/применение материалов
- 2.1 1) Получение и применение тугоплавких металлов
- 2.2 2) ТОП-5 таблицы Менделеева из числа самых тугоплавких металлов
- 2.2.1 А) Рений (Re)
- 2.2.2 B) Тантал (Ta)
- 2.2.3 C) Ниобий (Nb)
- 2.2.4 D) Молибден (Мо)
- 2.2.5 E) Вольфрам (W)
Что такое тугоплавкость металлов?
Суть термина должна быть ясна из самого словосочетания – это металлы, которые «туго» /тяжело плавятся. В большинстве научной и технической литературы, термин присваивается на основании минимальной температуры плавления химического элемента – от +2 200 градусов по Цельсию.

Важно: помимо основной пятерки тугоплавких металлов, преодолевающих отметку в 2 200, имеется и субподгруппа металлических веществ с температурой плавления в промежутке от 1 850 градусов до 2 2000.
Дополнительные химические элементы относятся к так называемой расширенной группе тугоплавких металлов – 9 веществ + 5 из основной группы. Существуют и другие металлы, у которых температура плавления входит в промежуток тугоплавких веществ, но они расположены в периодической системе за ураном (трансурановые).
В силу нестабильности изотопов + малого распространения по земной поверхности, трансурановые металлы не относят к группе тугоплавких.
Физические/химические свойства тугоплавких металлов:
- если не брать в расчет углерод с осмием, температурные показатели для плавления у веществ не имеет конкурентов в таблице Менделеева;
- высокий порог сопротивления к деформации вещества под постоянным воздействием давления механического типа (деформация ползучести). У обычных металлических элементов оговоренный порог начинается от 220 градусов, а у тугоплавких от 15000 градусов. Именно потому ковать железо куда проще, нежели изделие с ниобия или другого тугоплавкого вещества;
- благодаря простоте вступления в реакции соединения с прочими химическими элементами, найти тугоплавкие металлы в чистом виде почти нереально;
- на открытом воздухе тугоплавкие металлы окисляются очень медленно. Почти сразу на поверхности образовывается защитный слой в виде пленки;
- при нагревании неплавких металлов, те становятся уязвимыми к коррозии. Повышается их хрупкость + теряется 50%+ свойств.
Физические свойства тугоплавких металлов сильно отличаются из-за их принадлежности к различным группам. Все 100% элементов – тугоплавкие, но только 25% из них можно отнести к жаростойким. Подобное различие обусловлено сменой физических свойств при нагревании химического элемента. Металл может стать подвержен действиям агрессивных сред, таких как щелочи и кислоты. Детальнее по каждому из тугоплавких металлов будет ниже.
Самый тугоплавкий металл: 5 элементов группы + добыча/применение материалов
Тугоплавкие металлы тяжелы в обработке, но как компонент в сплавах они незаменимы. В 21 веке тяжело представить отрасль металлургии или другое подразделение промышленности, где можно обойти стороной титан или другие химические элементы рассматриваемой группы.
1) Получение и применение тугоплавких металлов
Важнейшая проблема добычи тугоплавких металлов заключается в их химической активности, что препятствует сохранению элемента в его чистом представлении. Продуктом производства является металлический порошок , добывающейся в специальной установке.

В 2020 году все еще не имеется высокотехнологично метода добычи тугоплавких металлов в чистом виде. Химические вариации имеют существенные недостатки, которые отображаются на продуктивности производства и качестве конечного продукта. О методах добычи тугоплавких металлов расскажет таблица ниже.
Методика Описание Популярность (из 5 ★) Восстановление через триоксид водорода Многоэтапная технология производства металлического порошка, реализующаяся в многотрубных печах с постоянным поддержанием температурного режима на уровне 800-1000 градусов Цельсия. Наибольшее распространение способ добычи приобрел среди таких тугоплавких металлов как молибден и вольфрам. ★★★★★ Восстановление через водород перрената. Алгоритм применяется в промышленном изготовлении рения. Температурный режим находится в пределах 480-520 градусов. На завершающем этапе производства происходит вымывание щелочи из стального порошка. Для этой цели применяется соляная кислота (раствор) + горячая вода. ★★★ Через металлические соли Схема добычи используется при выделении тугоплавкого металла, молибдена. В качестве основы берется соль аммония элемента + его порошок. Второй добавляется на уровне 6%-16% от массы всей смеси. Полученный состав подвергается термообработке при температуре 550-900 градусов Цельсия в инертной среде. Далее, производится восстановление молибдена в водородной среде при режиме температуры в 820-980 градусов. ★★★★ Получаемый порошок, перерабатывают в проволоку, арматуру, жестяные листы или фольгу путем уплотнения через специализированные плавильные печи. Наряду с нагревательным элементом, в конструкциях имеется прессовальные компоненты, которые из-за влияния высокой температуры способны деформировать материал как душе угодно. И все это из-за уязвимости некоторых представителей тугоплавких металлов к совокупному воздействию температуры и воздуха.

В рамках нашего государства, одним из крупнейших производителей порошка тугоплавких металлов является металлургийный завод Унеча. Предприятие сравнительно молодое, но его объемы производства растут стабильно каждый квартал. Основная специализация – чистый вольфрам + его карбиды.
Сферы применения тугоплавких металлов:
- как добавка в легированных сталях;
- в электротехнике – электроды, нити накаливания и прочие мелочи, где нужна жаростойкость;
- автомобилестроение. При производстве узлов зубчатого типа, валов, редукторов и прочих мелочей с высокими показателями прочности;
- как элементы двигателей в авиационных системах сплавы сверхпрочных металлов крайне необходимы;
- сопла ракет и реактивные двигатели постоянно подвергаются существенным температурным нагрузкам, из-за чего производство оговоренных деталей из жаростойких материалов крайне важно;
- военная сфера РФ и всего мира использует тугоплавкие металлы как основу для разработки сплавов, выступающих элементами брони, снарядов, патронов и прочей военной техники/снаряжения;
- фильтры, добавка в красителе и покрытие для огнестойкой одежды – эти и прочие мелочи как составная часть химической промышленности.
Не обошли тугоплавкие металлы и атомную энергетику. Трубы в ядерных реакторах, оболочки атомных электростанций и другие компоненты точек выработки электроэнергии при использовании термоустойчивых материалов становятся в разы безопаснее при ежедневном использовании со стороны человека.
2) ТОП-5 таблицы Менделеева из числа самых тугоплавких металлов
В данном разделе будет рассмотрена основная группа тугоплавких металлов, состоящих из 5 химических элементов. Расширенный вариант из +9 веществ – спорный вопрос, ибо пиковая температура плавления здесь ниже 2 200 градусов Цельсия, что накладывает на материалы существенные ограничения по областям применения в промышленности.
А) Рений (Re)

Распространенность ★★ (2.0 из 5.0) Общая привлекательность в промышленности
★★★★★
3.0Стоимость ★★ (2.0 из 5.0) Применение ★★★(3.0 из 5.0) Тугоплавкий металл, расположенный в периодической системе на 75 позиции. Занимает второе место по тугоплавкости в мире. Если рассматривать вещество в стандартных условиях, мы увидим плотную структуру и серебристый цвет с беловатым отблеском. Происхождение самого названия идет с Германии, а именно реки, в пределах которой вещество было впервые обнаружено – Рейн.
Обратите внимание: Менделеев заранее предсказал появление рения в таблице. Тогда он его называл «тримарганец». Вывод ученого основывался на аналогии свойств в периодической системе.
Официальное открытие рения произошла в 1925 году, что делает металл одним из самых молодых не только в рамках тугоплавких, но и масштабах всей системы. Автором открытия стал химик-немец Нодлак. Первый образец чистого химического вещества получилось выделить только в 1928 году, и то на один грамм пришлось тратить 650+ килограмм молибденита.
Физические свойства Химические свойства Один их самых твердых материалов на земле (4 место). Плотность вещества составляет 21 грамм на кубический сантиметр. Высокая устойчивость к составляющим воздуха при обычных условиях хранения/эксплуатации материала. Температура плавления выше 3 200, а температура кипения выше 5 600 градусов Цельсия. Умеренное окисление при температурах от 300 и сильное окисление при температуре от 600 градусов. В чистом виде порошок рения обладает пластичностью, но после обработки показатели прочности резко идут вверх. Причина – большой модуль упругости вещества. Рений способен многократно выдерживать цикл нагрева-охлаждения без потери в крепости структуры. Устойчивость к реакциям с азотными и водородными реагентами. Порошковый вид рения с водородом адсорбируется. Удельное сопротивление металла выше его конкурентов по группе тугоплавких. Во время нагревания вещества возможны реакции с кислотами на основе хлора и брома, но отношение к серной, соляной плавиковой кислотам инертное. Рений считается одним из самых редких металлов (да и веществ) на нашей планете. Стоимость 1 килограмма чистого вещества начинается от 1 300 и заканчивается 12 000 долларами. Ценник растет по мере увеличения чистоты порошка. Основными точками производства и добычи является Чили, США и Россия. Общий запас рения на 2020 год – 13 000 тонн, что позволит удовлетворять спрос на металл еще на протяжении 150-200 лет.
Области применения рения:
- как защитный слой против воздействия агрессивных сред. Хотя по сравнению с хромированием, покрытие из сплава рения будет куда дороже;
- как составляющий компонент при изготовлении жаропрочных сплавов;
- в ракетостроении – сопла двигателей и лопатки турбин;
- в военной промышленности для создания сплавов в реактивные двигатели с высокими показателями эффективности;
- как легирующая присадка;
- как добавка в сплавах для изготовления деталей высокой точности;
- из-за химической стойкости, рений применяется в покрытии внутренних частей емкостей для хранения агрессивных кислот.
В отношении биологических процессов и жизнедеятельности человеческого организма, то здесь рений не при делах. Металл хоть и принадлежит группе тугоплавких, его применение в промышленности не столь распространено из-за недостатка в объемах и высокой стоимости использования.
B) Тантал (Ta)

Распространенность ★★★ (3.0 из 5.0) Общая привлекательность в промышленности
★★★★★
3.5Стоимость ★★★ (3.0 из 5.0) Применение ★★★★ (4.0 из 5.0) Тантал расположен на 73 позиции таблицы. В стандартных условиях – это очередной серебристо-белый металл без каких-либо внешних отличительных признаков. Иногда в оттенках тантала можно встретить голубоватый цвет, который появляется вследствие наложения оксидной пленки. Открытие металл произошло в 1802 году, химиком-шведом Экебергом, но выделить в чистом виде металл удалось только в 1844 году. Потому элемент и назвали «Тантал». Пластичная разновидность тантала впервые была выделена в 1903 году немцем Болтоном.
Физические свойства Химические свойства Плавится при температуре в 3000 градусов, а закипает при 5 500 градусах. Окисление происходит только при температуре выше 280 градусов по Цельсию. Если речь о галогенах, то температурный порог – это 250 градусов. Невзирая на высокую плотность чистого вещества – почти 17 грамм на сантиметр кубический, пластичность тантала сравнима с золотом. При повышении температуры вещества входит в реакцию с С, В, Si, P, Se, Те и множеством других химических элементов. Металл является газопоглотителем (геттером). При температурах свыше 800, может поглощать до 800 объемов входящего газового вещества. В чистом виде металл проявляет устойчивость к влиянию щелочных металлов в жидком виде, кислотам органического происхождения и множеству других агрессивных сред. Обладает парамагнитными свойствами. По уровню устойчивости к реагентам, тантал сравнивают со стеклом. При температуре ниже 4,5 Кельвина переходит в сверхпроводящее состояние. Вещество нерастворимо в большинстве кислот/кислотных смесях. Добыча тантала происходит из танталовых руд. Основные месторождения расположены на территории Франции, Египта и Таиланда. Общее процентное содержание тантала в коре земли составляет 2.5*10 в -4 степени. В зависимости от типа пород, его долевое содержание может колебаться в 3-20 раз. Один килограмм тантала обойдется на рынке металлов от 240 долларов. Если же человек приобрести элемент высокой чистоты (до 99.9%), ему придется выложить сумму в 4 000+ долларов.
Применение тантала в промышленности и обиходе:
- составляющая антикоррозийных и жаропонижающих сплавов;
- компонент деталей в коррозионно-устойчивой аппаратуре в химии – лабораторная посуда, фильтры, тигли и так далее;
- пары цезия и расплавы менее всего влияют на тантал, что позволяет его использовать в теплообменниках систем ядерной энергетики;
- как проволока в криотронах.
Последние несколько лет тантал стал появляться и в украшениях. Обусловлено это его оксидной пленкой радужной расцветки. Метод добычи тантала – хлорирование, углеродное восстановление или электрохимический расплав. На одну тонну тантала с чистотой выше 80% уходит 3000 тонн руды.
C) Ниобий (Nb)

Распространенность ★★★★(4.0 из 5.0) Общая привлекательность в промышленности
★★★★★
4.0Стоимость ★★★★(4.0 из 5.0) Применение ★★★★(4.0 из 5.0) Элемент имеет 41 порядковый номер. Устаревшее название вещества – колумбий. Впервые металл открыли в 1801 году, выделив его из минерала колумбита. Вопросом занимался англичанин Хэтчет. Из-за сильной схожести свойств ниобия с танталом, его изначально считали за определенную разновидность второго. Свое нынешнее название элемент приобрел в 1844 году от немецкого химика Розе, который назвал металл в честь своей дочери.
Химические свойства ниобия:
- не взаимодействует с кислотами соляного, ортофосфорного, серного и азотного типа;
- может растворяться в едких щелочных растворах и серной кислоте при нагревании в 150+ градусов;
- прокаливание в воздухе приводит к окислению до оксида ниобия, у которого имеется больше 10 модификаций.
Ниобий получают из комплексных руд в 3 этапа – вскрывается концентрат, распределение тантала и ниобия в смеси и рафинирование + восстановление элемента с его сплавами из полученной смеси. Основной промышленный метод производства – карботермический. У ниобия только один стабильный изотоп, все остальные – радиоактивны. Из этого вытекают физиологические особенности тугоплавкого металла – пыль раздражает кожу с глазами, токсичность, паралич конечностей при попадании в организм человека.
Области применения ниобия:
- добавка в сплавы для изготовления деталей летательных аппаратов;
- использование для легирования цветных металлов;
- как часть сверхпроводящих элементов;
- в изготовлении электролитических конденсаторов, имеющих высокие показатели удельной теплоемкости;
- замена тантала в промышленности. Ниобий в дешевле и в 2 раза легче;
- как добавка при чеканке коллекционных монет.
Основные месторождения ниобия расположены в США, Японии и Бразилии. На территории России ниобий добывают в пределах Кольских островов. Биологическая роль ниобия в настоящее время не исследуется, и для организма человека особой роли не имеет.
D) Молибден (Мо)

Распространенность ★★★★(4.0 из 5.0) Общая привлекательность в промышленности
★★★★
4.0Стоимость ★★★★★ (5.0 из 5.0) Применение ★★★★(4.0 из 5.0) Впервые о молибдене мир услышал в 177 году от шведского химика Шееле. В чистом виде (металлический порошок), элемент был получен Берцелиусом в 1817 году через восстановление оксидом водорода. Массовая доля молибдена в земной коре составляет 3*10 в -4 степени. В чистом виде вещество найти не представляется возможным. Процентный рост элемента в породе растет пропорционально содержанию диоксида кремния. Вид молибдена в природе – молибдатная и сульфидная руды + еще 18 разновидностей минералов с незначительным процентным содержанием вещества.
Физические свойства Химические свойства Высокая твердость вещества – по шкале Мооса твердость составляет 4.5 балла. Хорошая устойчивость чистого вещества при комнатной температуре. Уровень мягкости металла обуславливается уровнем его чистоты. Окисление при повышении температуры свыше 400 градусов, а при превышении отметки в 600 процесс ускоряется в 10 раз. Низкий коэффициент теплового расширения. Электропроницательность по шкале Полинга составляет 2.16. Плавиться металл начинает при температуре больше 2600 градусов, а закипает при температуре в 4 650 градусов Цельсия. 5 разновидностей по степеням окисления – 2, 3, 4, 5 и 6. Самые крупные месторождения молибдена расположены в США, Мексике и Чили. В отношении России, молибден выпускают на специализированном заводе в Сорске. Выделилась и Армения – ее запасы молибдена составляют 7% от общемировых. Особенность тугоплавкого металла состоит в его концентрации среди космических тел. В красных гигантах имеется порядка 10% чистого вещества.
- для легирования сталей в качестве жаропрочного и коррозионностойкого элемента;
- в соединениях молибден выступает в качестве катализатора химических реакций;
- используется с целью получения технеция-99, который используется в медицине с целью диагностики онкологических заболеваний;
- космическая промышленность – компонент в зеркалах для лазеров газодинамического типа;
- как нагревательный элемент в высокотемпературных печах сопротивления вакуумного типа;
- держатели-крючки в лампочках накаливания делаются из низкопробного молибдена.
Биологическая роль молибдена в жизнедеятельности организма человека доказано в 1953 году. Элемент повышает действие антиокислителей, и является крайне важным веществом для нормального протекания процессов дыхания тканей. Недостаток молибдена в организме снижает защитные функции иммунной системы организма. Пыль из молибдена негативно влияет на дыхательные пути, вызывая неизлечимую болезнь – пневмокониоз.
Развернутое описание самого тугоплавкого металла в мире:
E) Вольфрам (W)

Распространенность ★★★★(4.0 из 5.0) Общая привлекательность в промышленности
★★★★★
4.5Стоимость ★★★★ (4.0 из 5.0) Применение ★★★★★ (5.0 из 5.0) Переходим к лидеру тугоплавкости среди металлов – вольфраму . Более высокую температуру плавления имеет углерод, но он не относится к неметаллическим элементам. Происхождение названия элемента уходит корнями в 16 век, когда сопровождаемый оловянные руды вольфрам препятствовал нормальной выплавке олова, превращая его в шлаковую пену. Официальное открытие тугоплавкого металла приходится на 1783 год от имени двух братьев из Испании Элюар.
Физические особенности свойств вольфрама:
- самый тугоплавкий материал в мире. Плавление наступает при достижении 3 400 по Цельсию, а кипение при 5 555 градусов;
- один из самых плотных материалов на земле – 19.25 граммов на сантиметр кубический. По Бринеллю плотность составляет 488 килограмм на миллиметр квадратный;
- имеет парамагнетические свойства;
- в чистом виде хорошо поддается ковке. Материал можно вытянуть на специализированном оборудовании в тонкую нить или сделать сверхтонкую пластину.
В отношении химии, у вольфрама возможны валентности от 2 до 6. Наилучшие показатели устойчивости у шестивалентного. Материал обладает высокими антикоррозийными устройствами. В ряде напряжений вольфрам расположился сразу после водорода. Растворимость в соляной, низко концентрированной серной и плавиковой кислотах.
- основа для нитей накаливания;
- входит в сплавы для противовесов в вооружении;
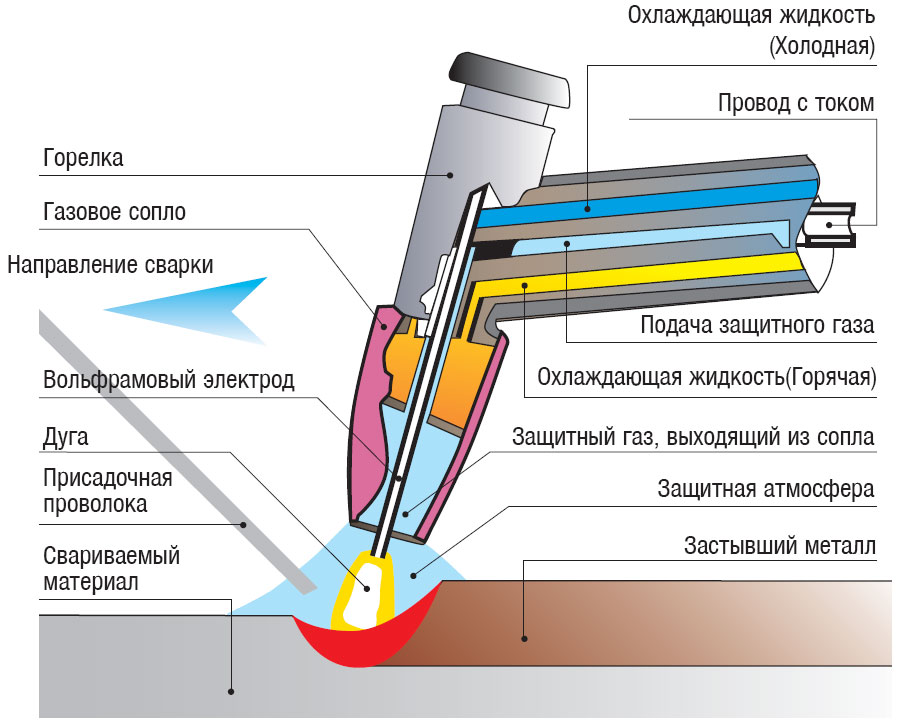
- электровод для сварки аргонодугового типа;
- в высокотемпературных вакуумных печах;
- как защита от ионизирующего излучения.
Рынок вольфрама в 2020 году предлагает за 1 килограмм самого тугоплавкого металла от 110 американских долларов. Если речь идет о низкопробном веществе, то можно надеяться на цену от 70 долларов. Биологической роли в организме человека вольфрам, сам по себе как элемент, не имеет.
Вольфрам — полезные свойства и особенности металла
Название этого элемента сразу вызывает ассоциации с электрической лампочкой. Нить накаливания, которая светится внутри стеклянной колбы, сделана из этого материала. Это вольфрам.

Что представляет собой
Вольфрам – это металл, химический элемент, занимающий ячейку периодической системы Менделеева № 74.
По блеску и сероватому цвету схож с платиной.
Относится к металлам «туговскипающей» и «тугоплавкой» групп. По тугоплавкости уступает только жидкому углероду. Данное свойство позволяет отличить его от других металлов.
Международное обозначение – W (Wolframium).
Как был открыт
Знакомство людей с вольфрамом датируется эпохой Средневековья.
Старатели
Вольфрам получали еще европейские старатели при восстановлении олова. Но его считали «мусором», засоряющим ценный элемент. Под влиянием вольфрамовой руды в процессе восстановления часть олова превращалась в шлак, уменьшая долю чистого вещества.
Отсюда присказка, которая появилась у старателей: «Вольфрам сжирает олово, как волк овечку».

Большой выбор украшений из натуральных камней и минералов со скидкой -50%
Наука
История открытия вольфрама связана с несколькими учеными-химиками:
- В середине 18 века швед Аксель Фредерик Кронштедт открыл тяжелый металл, названый им Tung Sten (по-шведски – тяжелый камень).
- Через 30 лет за дело взялся его соотечественник, член академии наук страны Карл Шееле. Свободное от работы в аптеке время он отдавал экспериментам в домашней лаборатории. Его считают «отцом» не только вольфрама. В списке также барий, марганец, кислород, хлор. Из вольфрамовой руды (тунгстена) он выделил соль кислоты, не числящейся в реестрах.
- Дальнейшую работу над соединением доверил испанским коллегам братьям Элюар. Которые и получили новый элемент.
Название и символ металла – Wolframium и W – предложил Йенс Якоб Берцелиус.
Этимология названия вольфрама имеет немецкие корни: Wolf Rahm («волчий крем/сливки»).
А тунгстен переименовали в честь ученого – в шеелит.
Как представлен в природе
Самородный цветной металл вольфрам на планете не встречается. Он представлен в виде руды либо минералов.
Руды состоят из соединений вольфрама с железом, марганцем, кальцием, иногда другими элементами, включая редкоземельные.
Минералы – это вкрапления в граниты (до 2%). Из них промышленное значение имеют вольфрамит (вольфрам с железом и марганцем) и шеелит (с кальцием).
Каждая тонна земной коры содержит 1,30 г вольфрама.
Физико-химические характеристики
Чистый вольфрам – в числе первых по плотности, твердости, первый по температуре плавления и кипения среди металлов. Эти физические свойства дополняет химическая стойкость даже при запредельных температурах.
Свойства атома Название, символ, номер Вольфра́м / Wolframium (W), 74 Атомная масса
(молярная масса)183,84(1) а. е. м. (г/моль) Электронная конфигурация [Xe] 4f14 5d4 6s2 Радиус атома 137 пм Химические свойства Ковалентный радиус 170 пм Радиус иона (+6e) 62 (+4e) 70 пм Электроотрицательность 2,3 (шкала Полинга) Электродный потенциал W ← W3+ 0,11 В
W ← W6+ 0,68 ВСтепени окисления +2, +3, +4, +5, +6 Энергия ионизации
(первый электрон)769,7 (7,98) кДж/моль (эВ) Термодинамические свойства простого вещества Плотность (при н. у.) 19,25 г/см³ Температура плавления 3695 K (3422 °C, 6192 °F) Температура кипения 5828 K (5555 °C, 10031 °F) Уд. теплота плавления 285,3 кДж/кг
52,31 кДж/мольУд. теплота испарения 4482 кДж/кг 824 кДж/моль Молярная теплоёмкость 24,27 Дж/(K·моль) Молярный объём 9,53 см³/моль Кристаллическая решётка простого вещества Структура решётки кубическая
объёмноцентрированнаяПараметры решётки 3,160 Å Температура Дебая 310 K Прочие характеристики Теплопроводность (300 K) 162,8 Вт/(м·К) Номер CAS 7440-33-7 При 1580°C легко куется, вытягивается до тонкой проволоки.
Данные преимущества создает структура вещества.

На воздухе с относительной влажностью менее 60% сопротивление металла коррозии стопроцентное.
Месторождения, добыча
Месторождения вольфрамовой руды на планете не редкость, запасы оцениваются миллионами тонн.
Крупнейшими залежами располагают КНР, Казахстан, Канада, США. Меньше сырья у России, Португалии, Узбекистана, других стран.
Глобальные объемы производства – 48-51 тысяча тонн вольфрама ежегодно. Безусловный лидер Китай (80%).
Добыча ведется закрытым либо карьерным способом.

Более 8000 видов товара из 500 разновидностей натурального камня. Ежедневное обновление!
Технология получения
Вольфрамовые руды из разных мест добычи содержат 0,3-2,5% оксида металла. Поэтому промышленное получение продукта из руды начинается на обогатительных предприятиях.
Это многоступенчатый процесс:
- Дробление руды.
- Шлифовка.
- Флотация.
- Обжиг.
Тугоплавкость оказалась недостатком, исключающим классическую плавку.
Твердые формы создают методом порошковой металлургии:

- Порошок спрессовывают.
- Спекание проводят при 1250-1300°C в водороде.
- Воздействуют электричеством.
- Нагревают до 3000°C, добиваясь монолитного спекания.
Дополнительно металл очищают зонной плавкой.
Номенклатура марок металла
На основе вольфрама или с его участием металлурги выплавляют продукт десятков наименований и марок.
Среди самых распространенных – чистый вольфрам (ВЧ) и сплав с рением (ВР).
Классификация марок вольфрама основывается на составе присадок:
Название марки Вид присадки ВА Алюминий + кремнистая щелочь ВМ Торий + кремнистая щелочь ВИ Окись иттрия ВТ Окись тория ВЛ Окись лантана Как используется
Свойства вольфрама обозначили главного потребителя. Это металлургия. Она создает конечный продукт и исходники для других отраслей промышленности.
Порошковый вольфрам – основа либо компонент твердых, жаропрочных износоустойчивых сплавов, премиальных марок сталей.
Металл, сплавы
Из тугоплавкого металла и сплавов создают широкий ассортимент продукции:

- Узлы и детали авиационных, ракетных двигателей.
- Элементы электровакуумных приборов (кинескопы, нити накаливания).
- Нагреватели вакуумных печей.
- Электроды для аргонно-дуговой сварки. Они не плавятся, создают прочный сварной шов. Пригодны для материалов любого состава (цветные металлы, легированные стали, другие).
- Емкости для радиоактивных продуктов. Здесь решающими оказались преимущества металла перед свинцом.
- Хирургический инструментарий.
Характеристики металла подошли оборонному комплексу: танковая, торпедная броня, крупнокалиберные снаряды, пули. А также суперскоростные роторы гироскопов, контролирующих траекторию полета баллистических ракет.

Соединения
Обширен спектр применения вольфрамовых соединений:
- Без дителлурида невозможно преобразование тепла в электричество.
- Карбид – основа сплавов и композитов для механической обработки металлов и неметаллов. У горнодобытчиков, нефтяников, газовиков – для бурения скважин.
- Сульфид – термостойкая (до 500°C) смазка.
- Трехокись – материал для создания электролита топливных элементов, работающих при повышенных температурах.
Соединения вольфрама закупают производители лаков, красок, текстиля.
Другие формы
Изотоп W184 – компонент сплавов с изотопами урана. Из них делают ракетные двигатели на ядерном топливе.
Радионуклид искусственного происхождения (W185) востребован как детектор излучений (включая рентгеновское) ядерным сегментом физики и медицины.
Значение для человека
Тугоплавкий металл не имеет значения для человека как биологического организма.
Опасность представляет лишь вдыхание вольфрамовой пыли.
Цены
На рынке торгуют металлическим вольфрамом (чистота 99%) и полуфабрикатами (пруток, проволока, полоска).
Порядок цены на металл – 50 500$ за тонну. Полуфабрикаты дороже вдвое-втрое.
https://wikimetall.ru/spravochnik/samyj-tugoplavkij-metall.html