Какой из этих металлов может плавиться в руке человека
Металл который плавится в руке: понятие легкоплавкости + характеристика галлия + разбор термодинамических свойств химического элемента + физические/химические свойства металла + его область применения.

Многие из нас видели в интернете фото металла, который плавится в руке. Единственный химический элемент в природе, который может безопасно для здоровья человека, провернуть подобный трюк – галлий.
В сегодняшней статье мы разберем отличительные свойства группы легкоплавких металлов + предоставим характеристику элемента, тающего в руках его владельца.
Понятие легкоплавких металлов/сплавов
Легкоплавкость – понятие растяжимое, особенно это актуально для промышленности. В химии легкоплавкими считаются элементы группы металлов + их сплавы, температура плавления которых ниже порога в 1000 градусов Цельсия.

Если температура плавления металла превышает 1 500 градусов Цельсия – его принято выделять в группу тугоплавких. Диаграмма выше четко дает понять, куда какой металл следует относить.
Обратите внимание: минимальная температура плавления у ртути — 39 градусов. Именно благодаря такому физическому свойству, мы можем наблюдать химический элемент в постоянно жидком состоянии.
Теперь пройдемся по легкоплавким сплавам. В своем большинстве – это сплавы эвтектического типа, пиковая температура плавления которых не превышает 232 градусов по Цельсию. В основе производства легкоплавких сплавов лежат легкоплавкие металлы – олово, висмут, таллий, галлий и другие.

Ученым удалось добиться -78 градусов в качестве минимальной температуры плавления для советского сплава, который состоит на 12% из натрия, 47% калия и 41% цезия. Недостаток сплава — реакция с водой. Ближайший конкурент – амальгама. Токсичный сплав из ртути с таллием, сохраняющий жидкое состояние до температуры -61 градус по Цельсию.
Область применения легкоплавких металлов/сплавов:
- энергетическая промышленность и машиностроение. Основное направление – создание тепловых носителей с жидкометаллического типа;
- литьевая промышленность;
- как основа для датчиков температуры, что актуально в системах пожарной безопасности;
- как основа для разработки термометров;
- как ремонтный материал в вакуумных технологиях;
- припои, предохранители и прочие мелочи в микроэлектронике;
- медицинское направление. То же протезирование;
- как металлическая смазка.
Низкая температура плавления является базовых свойством, которое требуется от легкоплавких металлов и сплавов. Вторичные параметры, которые берутся во внимание в различных областях использования – плотность, прочность на разрыв и инертность в химическом плане.
Галлий: металл, который плавится в руках
Поистине, занимательный химический элемент, который имеется в любом школьном кабинете химии. Благодаря демонстрационной наглядности, галлий считается лучшим вариантом донесения до умов учащихся тепловых свойств химических элементов.

Gallium (Ga) – металл, который плавится в руках при достижении температуры в 29.8 градуса по Цельсию . Учитывая стандартные 36.6 в организме человека, чтобы получить желаемый эффект, достаточно кусочек галлия положить на ладошку и наблюдать как тот медленно по ней растекается в разные стороны.
1) Общая информация по элементу
В периодической системе химических элементов галлий находится на 31 позиции. Его латинское обозначение – «Ga». Металл принадлежит к группе легких металлов, куда также входит алюминий, индий, олово, таллий, свинец и висмут.

Внешне, галлий представляет собой мягкий или хрупкий металл (в зависимости от температуры), имеющий белый + серебристый оттенки. Иногда можно заметить синеватые отблески на поверхности чистого вещества.

Великий Менделеев заранее знал о данном химическом элементе. Впервые он просчитал некоторые свойства галлия еще в 1871 году. Изначальное название, присвоенное химиком, звучало как «экаалюминий».
К предугаданным свойствам галлия Менделеевым относились:
- оксидный тип;
- варианты связи с хлором;
- медленная растворимость при соприкасании с щелочами/кислотами;
- галлий не будет реагировать с кислородом;
- возможность легкоплавкого металла образовывать основные соли;
- химический элемент будет открыт при использовании спектроскопии.
Непосредственное выделение металла в чистом виде пришлось на француза Буабодраном. Открытие приходится на 1875 год. Из-за малого долевого содержания галлия в руде (менее 0.2%), пришлось потратить пару месяцев на получение минимального запаса чистого вещества для полноценного исследования его физических/химических свойств.
| Физика галлия | Химия галлия |
|---|---|
| Наличие нескольких модификаций полиморфного типа. | Низкая химическая активность замедляет протекание химических реакций металла в твердом состоянии. |
| При нормальных условиях кристаллическая решетка имеет орторомбическую структуру. При повышении давления наблюдается образование 2 структур полиморфного типа с кубической и тетрагональной решетками. | На воздухе галлий покрывается оксидной пленкой, которая предохраняет его от дальнейших реакций окисления. |
| Плотность галлия – 5.9 грамма на сантиметр кубический, а в жидком состоянии плотность увеличивается до 6.1 грамма на сантиметр кубический. | В контакте с горячей водой, он вытесняет из нее водород, в результате чего образуется гидроксид галлия. |
| Сопротивление электричеству у галлия в твердом и жидком состояниях одинаковы и равны 0.5 на 10-8 Ом*см при температурном режиме в 0 градусов по Цельсию. | Вступает в реакцию с паром (выше 340 градусов) и образует метагаллиевую кислоту. |
| Вязкость галлия колеблется в зависимости от температурного режима. При температуре в 100 градусов – 1.6 сантипуаз, а при 1000 градусов С – 0.6 сантипуаз. | Может взаимодействовать с кислотами минерального типа – происходит выделение Н и образование солевых веществ. |
| Поверхностное натяжение составляет 0.74 ньютона на метр, а отражательный коэффициент от 71% до 76% при разной длине волн. | Галлий инертен по отношению к водороду, азоту, углероду и кремнию. |
В земной коре металл, который плавится в руках, встречается довольно часто. На 1 тонну земли приходится 19 грамм чистого вещества. В химическом аспекте, галлий – элемент рассеянного типа, располагающий двойной природой по геохимии. Хотя кларки вещества и большие, из-за его сильной склонности к изоморфизму, больших скоплений чистого галлия в природе не найти.

К основным минералам, где сравнительно высокое содержание галлия в чистом виде относят сфалерит (до 0.1%), биотит (до 0.1%) и натролит (до 0.1%). В остальных 10+ минералах, которые также применяются для добычи галлия, долевое содержание чистого вещества менее 0.1%. В морской воде галлий также присутствует, но его содержание крайне мало – всего 30 на 10-6 миллиграммов на литр жидкости.
2) Почему галлий – это металл, который плавится в руке?
Обратимся к тепловым свойствам металла, и полностью разберем их при различных уровнях, хотя ответ на вопрос очевиден уже из базового понятия, температуры плавления, которая приравнивается к 29 градусам по Цельсию.
Термодинамические свойства чистого галлия:
- металл переходит из твердого в жидкое состояние при достижении температуры в 29.8 С или 302 градуса Кельвина;
- металл закипает при достижении температуры в 2 448 градусов Кельвина;
- удельная теплота плавления чистого галлия составляет 5600 Джоулей на моль;
- удельная теплота по испарению составляет 270 000 джоулей на моль;
- молярная теплоемкость составляет 26 джоулей, деленных на Кельвины, перемноженные на моли.
Главными поставщиками галлия на мировой рынок являются государства из Юго-Запада Африки, Российская Федерация и большинство стран СНГ. Галлий – металл, который не только плавится в руке, но и вещество, способное менять плотность при смене температурного режима на основании данного свойства можно провести интересный опыт.

Эксперимент: переводим галлий в жидкое состояние, а далее загоняем его в маленький стеклянный пузырек. По мере охлаждения емкости, металл станет постепенно превращаться в твердую субстанцию. Постепенно образующиеся кристаллы начнут расширяться, за счет чего колба рано или поздно треснет.
Во избежание повреждений со стороны зрителей, демонстрация должна проходить в изолированном пространстве с защитной перегородкой. Если слишком резко переохладить колбу, осколки могут разлететься в разные стороны в радиусе нескольких десятков метров.
Обзор свойств и характеристик плавящегося в руке металла, галлия:
3) Получение галлия + области применения металла в промышленности/быту
В основе добычи чистого вещества лежит галлит – редкий минерал, который является смесью галлия и сульфида меди. Наиболее часто он встречается в совокупности с такими минералами как сфалерит и германит. Странный факт, но в залежах каменных углей иногда реально найти галлит в размере 1.5% от всего объема добычи, что делает такие месторождения крайне важными стратегическими запасами для промышленного производства галлия.
Основные методы получения металлического галлия – это переработка боксита, нефелина и некоторые типы полиметаллических руд/угля.
Алгоритм извлечения галлия из руд:
- Электролиз с участием щелочных жидкостей, которые в свою очередь являются промежуточным продуктом с переработки бокситов в глинозем технического применения.
- Получение концентрированных растворов по методу спекания или через процесс Байера. В первом случае получаем до 70 миллиграмм на литр, а во втором до 160 миллиграмм на литр концентрата.
- Дальнейшая очистка галлия путем карбонизации.
- Обогащенный осадок отправляют в емкость с известью, вследствие чего получаем раствор.
- При помощи электролиза раствора получаем черновой вариант металла.
- Черновой галлий прогоняют через водяной напор.
- Смесь фильтруют при помощи пористых пластинок и греют в вакууме, из-за чего из чернового металла удаляются примеси летучего типа.
- В зависимости от степени чистоты конечного продукта, используют химический, электрохимический, либо физический методы разложения.
Эталонный вариант чистки может предоставить галлий с чистотой в 99.9%. В данном случае используется метод электрохимического рафинирования и восстановление с помощью очищенного водорода.

В промышленном плане у галлия нет широкого распространения. Металл сравнительно дорогой для металлургии + его физические/химические свойства редко где могут пригодиться для массового использования.
Где применяется галлий:
- в соединениях с натрием металл применяют при создании лазеров полупроводникового типа с ультрафиолетовым и синим диапазонами;
- как присадка к германию/кремнию;
- как отражающий элемент для зеркал среднего качества. В чистом виде материал способен отражать порядка 89% света. Достоинства подобных изделий обусловливаются способностью металл к пропуску ультрафиолетовых лучей;
- как компонент в смазочных материалах. Клеи с добавкой жидкого галлия весьма популярны и сегодня;
- как замена ртути в кварцевых термометрах;
- оксид галлия – это стратегически важный объект в производстве лазерных материалов.
Иногда галлий применяют как компонент для светящихся красок, а соли на основе металла являются катализаторами в аналитической химии, медицине и органическом синтезе. Чтобы купить 1 килограмма металла, который плавится в руках, потребуется выложить от 250 до 400 американских долларов в зависимости от степени чистоты химического элемента.
Галлий – металл, который плавится в руках
Галлий – металл, который плавится в руке. Вещество имеет температуру плавления, что составляет 29,76 о С. Если поместить его в теплую ладонь, оно постепенно начинает переходить из твердого состояния в жидкую форму.
Краткий экскурс в историю

Как называется металл, который плавится в руке? Как уже было отмечено выше, такой материал известен под определением галлий. Его теоретическое существование предсказал в далеком 1870 году отечественный ученый, автор таблицы химических элементов – Дмитрий Менделеев. Основой к возникновению такого предположения стало изучение им свойств многочисленных металлов. На то время ни одному теоретику не могло прийти в голову, что металл, который плавится в руках, существует в реальности.
Возможность синтеза чрезвычайно легкоплавкого материала, появление которого предсказывал Менделеев, доказал французский ученый Эмиль Лекок де Буабодран. В 1875 году ему удалось выделить галлий из цинковой руды. Во время опытов с материалом ученый получил металл, который плавится в руках.
Известно, что Эмиль Буабодран испытывал значительные трудности с выделением нового элемента из цинковой руды. В ходе первых опытов ему удалось добыть всего лишь 0,1 грамма галлия. Однако даже этого оказалось достаточно, чтобы подтвердить удивительное свойство материала.
Где встречается галлий в природе

Галлий относится к элементам, которые не встречаются в виде залежей руд. Материал очень рассеян в земной коре. В природе он встречается в составе крайне редких минералов, таких как галлит и зенгеит. В ходе лабораторных опытов небольшое количество галлия можно выделить из руд цинка, алюминия, германия, железа. Иногда его находят в бокситах, залежах угля, прочих месторождениях полезных ископаемых.
Как получают галлий
В настоящее время ученые чаще всего синтезируют металл, который плавится в руках, из алюминиевых растворов, что добываются в ходе переработки глинозема. В результате удаления основной массы алюминия и проведения процедуры неоднократного концентрирования металлов получают щелочной раствор, в котором находится незначительная доля галлия. Выделяют такой материал из раствора путем электролиза.
Сферы применения

Галлий по сей день не нашел применения в промышленности. Виной всему широкое использование алюминия, который обладает схожими свойствами в твердом виде. Несмотря на это, галлий выглядит перспективным материалом, поскольку обладает отменными полупроводниковыми качествами. Такой металл потенциально может быть использован для производства элементов транзисторов, высокотемпературных выпрямителей тока, солнечных батарей. Галлий выглядит прекрасным решением для изготовления покрытий оптических зеркал, которые будут обладать высочайшей отражательной способностью.
Главным препятствием на пути к применению галлия в промышленных масштабах остается высокая стоимость его синтеза из руд и минералов. Цена за тонну такого металла на мировом рынке составляет более 1,2 миллиона долларов.
На сегодняшний день галлий нашел эффективное применение лишь в сфере медицины. Металл в жидкой форме применяется в целях замедления потери костной массы у людей, что страдают от онкологических недугов. Его используют для быстрой остановки кровотечений при наличии крайне глубоких ран на теле пострадавших. В последнем случае закупорка сосудов галлием не приводит к образованию тромбов.
Интересные опыты с галлием

Как уже отмечалось выше, галлий – металл, который плавится в руках. Поскольку температура, что требуется для перехода материала в жидкое состояние, составляет чуть больше 29 о С, его достаточно подержать в ладонях. Через некоторое время изначально твердый материал начнет плавиться буквально на глазах.
Довольно увлекательный эксперимент можно провести с затвердеванием галлия. Представленный металл имеет свойство расширяться в ходе затвердевания. Для проведения интересного опыта достаточно поместить жидкий галлий в стеклянный пузырек. Далее необходимо начать охлаждать емкость. Через некоторое время можно заметить, как в пузырьке станут образовываться кристаллы металла. Они будут иметь синеватый цвет, в отличие от серебристого оттенка, который характерен для материала в жидком состоянии. Если не прекращать охлаждение, кристаллизирующийся галлий в конечном итоге разорвет стеклянный пузырек.
В заключение
Вот мы и выяснили, какой металл плавится в руке. Сегодня галлий можно отыскать в продаже для проведения собственных опытов. Однако обращаться с материалом следует крайне осторожно. Твердый галлий является нетоксичным веществом. Однако продолжительный контакт с материалом в жидкой форме может привести к самым непредвиденным последствиям для здоровья, вплоть до остановки дыхания, паралича конечностей и вхождения человека в состояние комы.
Наиболее легкоплавкие металлы: свойства, особенности, физические характеристики

Температура плавления – важная характеристика, которая чаще всего применяется именно к металлам. Она зависит от многих физических свойств веществ – их чистоты и кристаллической структуры. Какой металл наиболее легкоплавкий: Li, Al, Hg, Cu? Давайте выясним, кто из них действительно может называться таковым.
Наиболее легкоплавкие металлы
Плавление – процесс перехода из твердого состояния в жидкое. Он происходит под воздействием тепла, но зависит еще от ряда физических факторов, например от давления. Важную роль в том, насколько легко и тяжело вещество поддается плавлению, также играет его состав, размер кристаллов в решетке и прочность связей между атомами.
Температура плавления металлов очень разнится и может иметь даже минусовые значения. Она колеблется от -39 до +3410 градусов Цельсия. Тяжелее всего в жидкость превращаются молибден, вольфрам, хром, титан. Для этого процесса их требуется нагреть до температуры не менее 2000 градусов.
Наиболее легкоплавкими металлами являются галлий, ртуть, литий, олово, свинец, цинк, индий, висмут, таллий. Подробнее о некоторых из них читайте далее.

Ртуть
Полезный во многих сферах, но ядовитый металл был известен еще до нашей эры. Ртуть использовали античные и средневековые медики для лечения венерических и многих других заболеваний, алхимики пытались сделать из нее золото. Сегодня она применяется в электротехнике, приборостроении и органической химии.
Руть – это наиболее легкоплавкий металл на планете. При нормальных комнатных условиях она всегда жидкая, так как температура ее плавления составляет -39 градуса. Ее пары очень опасны, поэтому ртуть содержат только в контейнерах и специальных стеклянных колбах. На организм она действует как яд, отравляя его и выводя из строя нервную, иммунную, дыхательную и пищеварительную системы.
Галлий
Вторым в списке наиболее легкоплавких металлов находится галлий. Он становится жидкостью при температуре выше 29,5 градусов Цельсия, и размягчить его можно просто подержав немного в руках. При нормальных условиях галлий очень хрупкий, легко поддается механическому воздействию и окрашен в светло-серебристый, несколько голубоватый оттенок.
Металл очень рассеян в земной коре и не встречается в виде самородков. В природе его находят в составе различных минералов, таких как гранат, мусковит, турмалин, хлорит, полевой шпат. Кроме того, он содержится в морской воде. Галлий используют в высокочастотной электронике, для изготовления зеркал и различных сплавов.

Индий
В качестве простого вещества индий очень светлый, ковкий и мягкий настолько, что даже оставляет след, если им провести по бумаге. Он также является одним из наиболее легкоплавких металлов, но воздействуют на него только температуры выше 157 °C. Закипает он при 2072 градусах.
Как и галлий, индий не образует собственных месторождений, но содержится в различных рудах. Благодаря своей рассеяности в природе металл довольно дорогой. Его применяют в микроэлектронике, для изготовления легкоплавких сплавов, припоев, жидкокристаллических экранов для техники.

Олово
Олово плавится от температуры выше 231 градуса по Цельсию. Это пластичный и мягкий металл, светло-серебристого цвета. Оно существует четырех аллотропных модификациях, две из них появляются только при высоком давлении.
Олово довольно рассеяно в природе, но может образовывать собственные минералы, например, станнин и касситерит. Его используют в качестве покрытия для металлов для усиления их устойчивости к коррозии, а также для производства жести, фольги, разнообразных сплавов, посуды и деталей для музыкальных инструментов.
Литий
Литий – наиболее легкоплавкий металл, который становится жидкостью при температуре 180 градусов. Он мягкий, хорошо поддается ковке и механической обработке. Он относится к щелочным металлам, но проявляет активность гораздо хуже остальных представителей группы. Он медленно реагирует с влажным воздухом, а в сухой атмосфере остается практически стабильным

Металл встречается в сподумене, лепидолите, в месторождениях с оловом, висмутом и вольфрамом, содержится в морской воде и в звездных космических объектах. Литий часто используется для изготовления гальванических элементов, аккумуляторов, применяют в качестве окислителя, а также в пиротехнике. В сплавах с кадмием, медью и алюминием используется в космической, военной и авиационной технике.
Какой из этих металлов может плавиться в руке человека



Даниил, ну и дебилы: «Контакт кожи с галлием приводит к тому, что сверхмалые дисперсные частицы металла остаются на ней. Внешне это выглядит как серое пятно.
Клиническая картина острого отравления: кратковременное возбуждение, затем заторможенность, нарушение координации движений, адинамия, арефлексия, замедление дыхания, нарушение его ритма. На этом фоне наблюдается паралич нижних конечностей, далее — кома, смерть. Ингаляционное воздействие галлий-содержащего аэрозоля в концентрации 50 мг/м³ вызывает у человека поражение почек, равно как и внутривенное введение 10-25 мг/кг солей галлия. Отмечается протеинурия, азотемия, нарушение клиренса мочевины[6].»

Даниил, Тогда живи спокойно

Даниил, ни у одного учителя химии нет килограммового запаса галлия, это тоже самое что ртуть в школе хранить, малой, да ты пиздишь!

Анатолий, если люди ко мне нормально , то и я к ним нормально!
А т.к чурки Не люди, то я с ними с этими Свинообезьянами и обращаюсь соответственно.
Иван, Уедешь в Турцию отдыхать там к тебе также относится будут, как с хомячком или назойливой мухой. Приятно?
Иван, вы заебали, 21 век на дворе, интернет под рукой нужен не только для того чтобы в вк сидеть. так трудно залезть на ту же википедию?
«Арсенид галлия GaAs — перспективный материал для полупроводниковой электроники.
Нитрид галлия используется в создании полупроводниковых лазеров и светодиодов синего и ультрафиолетового диапазона. Нитрид галлия обладает превосходными химическими и механическими свойствами, типичными для всех нитридных соединений.
Показать полностью.
Изотоп галлий-71 является важнейшим материалом для регистрации нейтрино и в связи с этим перед техникой стоит весьма актуальная задача выделения этого изотопа из природной смеси в целях повышения чувствительности детекторов нейтрино. Так как содержание 71Ga составляет в природной смеси изотопов около 39,9 %, то выделение чистого изотопа и использование его в качестве детектора нейтрино способно повысить чувствительность регистрации в 2,5 раза.
Галлий дорог, в 2005 году на мировом рынке тонна галлия стоила 1,2 млн долларов США, и в связи с высокой ценой и в то же время с большой потребностью в этом металле очень важно наладить его полное извлечение при алюминиевом производстве и переработке каменных углей на жидкое топливо.
Галлий имеет ряд сплавов, жидких при комнатной температуре, и один из его сплавов имеет температуру плавления 3 °C (эвтектика In-Ga-Sn), но с другой стороны галлий (сплавы в меньшей степени) весьма агрессивен к большинству конструкционных материалов (растрескивание и размывание сплавов при высокой температуре). Например, по отношению к алюминию и его сплавам галлий является мощным понизителем прочности, (см. адсорбционное понижение прочности, эффект Ребиндера). Это свойство галлия было ярчайше продемонстрировано и детально изучено П. А. Ребиндером и Е. Д. Щукиным при контакте алюминия с галлием или его эвтектическими сплавами (жидкометаллическое охрупчивание). Как теплоноситель галлий малоэффективен, а зачастую просто неприемлем.
Галлий — превосходный смазочный материал. На основе галлия и никеля, галлия и скандия созданы очень важные в практическом плане металлические клеи.
Металлическим галлием также заполняют кварцевые термометры (вместо ртути) для измерения высоких температур. Это связано с тем, что галлий имеет значительно более высокую температуру кипения по сравнению с ртутью.
Оксид галлия входит в состав ряда стратегически важных лазерных материалов группы гранатов — ГСГГ, ИАГ, ИСГГ и др.»
Читайте также:
- Эмаль ос 12 03 расход на 1 м2 металла
- Металлический каркас для тумбы под аквариум
- Что такое активный металл в химии
- Как происходит сварка металла
- Вольт амперная характеристика металлического проводника
Температура плавления и кипения, превращения в жидкое или газообразное состояние разных металлов
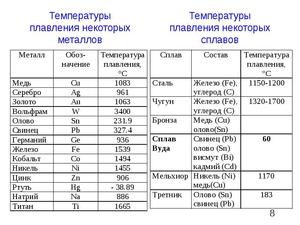
Любой из металлов имеет конкретные физические и химические характеристики и свойства. Один из важнейших параметров — температура, при которой металл теряет свою твердую форму и превращается в жидкость. Другими словами это процесс перехода вещества из одного агрегатного состояния в другое. Теряется твердая кристаллическая структура, присущая большинству металлов на земле, и вещество становится жидким.
Для обеспечения этого процесса требуется целенаправленный нагрев в течение определенного периода времени. Такое воздействие осуществляется, пока материал не достигнет температуры плавления. Далее от начинает течь. Если прекратить нагрев, температура начнет снижаться, материал вернет себе прежнее агрегатное состояние, т.е. начнет затвердевать. При этом предыдущая его форма, частично или полностью утерянная при плавлении, не будет восстановлена.
Рекордсмены среди металлов
Наибольшая температура, при которой металл переходит из твердого состояния в жидкое, у вольфрама. Чтобы он начал плавится необходимо, нагреть металл до температуры 3 422℃.
Наименьшая температура плавления у ртути. Она составляет всего 39 ℃. Поэтому этот металл в естественной для нашей планеты среде чаще всего представляет собой жидкость. Именно в таком состоянии мы его и видим. Но это единственное его отличие от привычных нам твердых металлов.
Узнать значение температуры, при которой тот или иной сплав металлов начинает плавиться, без нагревания невозможно. Этот показатель зависит не только от металлов, которые составляют сплав, но и от их удельного веса в общем объеме материала.

Как происходит процесс плавления металлов
Процесс преобразования твердого вещества в жидкое одинаков практически у всех металлов. Происходит он под действием внешних повышенных температур или внутреннего нагрева вещества. Внешнее воздействие обеспечивается в специальной термической печи. Внутреннее происходит путем пропускания через металл электрического тока. Называют эту технологию плавления металла индукционный нагрев, он происходит в электромагнитном поле с высокими частотами. Эффект от того или иного способа нагрева одинаков.
При повышении температуры материала происходит увеличение диапазона тепловых колебаний молекул вещества, что приводит к потере кристаллической решеткой своей структуры. Она теряет стабильность по причине роста свободных дислокаций, уменьшения силы внутренних связей, усиления хаотичности движения атомов и т.д. В ходе этих процессов происходит разрыв связей между атомами, они получают энергию, чтобы противостоять силе связывающего их друг с другом притяжения. Постепенное повышение температуры металла приводит к возникновению на его поверхности так называемой квази-жидкой прослойки.
Время, в течение которого происходит разрушение кристаллической решетки, и увеличение очагов металла в жидком состоянии, называют плавлением.

Разделение металлов
Учитывая, что температура плавления металлов разная их подразделяют в зависимости от этого показателя на три основные группы:
- Легкоплавкие. Это группа металлов, к числу которых относятся олово, свинец, кадмий и другие. Они теряют свое твердое состояние при температуре не выше 600℃.
- Среднеплавкие. Температура разогрева таких металлов до состояния плавления расположена в диапазоне от 600 до 1600℃. В их число входят такие металлы, как железо, медь, золото и т.д. Группа включает больше половины всех известных человеку металлов.
- Туго или трудноплавкие. Чтобы такой металл расплавился, нужно произвести его нагрев до температуры свыше 1600℃. В эту группу входят такие металлы, как титан, вольфрам, хром и прочие.
Подбор оборудования или технологии расплавления металла зависит от температуры его плавления. Чем больше этот показатель, тем более прочным должно быть приспособление для температурного воздействия. Узнать точно, до какой температуры нужно нагреть тот или иной металл, чтобы он расплавился, можно в таблице.
Кроме этого важное значение имеет и температура, при которой вещество переходит в следующее агрегатное состояние – газ. Это температура, при которой атомы в веществе движутся с такой скоростью, что практически теряются связи между ними, при этом они, отрываясь от основной массы, отправляются в свободный полет и смешиваются с окружающей воздушной средой. При такой температуре вещество начинает кипеть. Этот показатель равен температуре насыщенного пара вещества, который возникает под плоской коркой на поверхности кипящей жидкости.
Обе величины фиксируются в условиях нормального для поверхности Земли давления. При этом давление и температура плавления — величины прямо пропорциональные.
Повышается давление – растет температура плавления, снижается давление — падает скорость плавления металла.
Перечень металлов, которые входят в группу легкоплавких, которые начинают течь при температуре до 600℃:
| № п/п | Наименование металла | Его обозначение на латинском | Температура плавления | Температура кипения |
| Олово | Sn | 232 ℃ | 2600 Со | |
| Свинец | Pb | 327 ℃ | 1750 Со | |
| Цинк | Zn | 420 ℃ | 907 Со | |
| Калий | K | 63,6 ℃ | 759 ℃ | |
| Натрий | Na | 97,8 ℃ | 883 ℃ | |
| Ртуть | Hg | 38,9 ℃ | 356.73 ℃ | |
| Цезий | Cs | 28,4 ℃ | 667.5 ℃ | |
| Висмут | Bi | 271,4 ℃ | 1564 ℃ | |
| Палладий | Pd | 327,5 ℃ | 1749 ℃ | |
| Полоний | Po | 254 ℃ | 962 ℃ | |
| Кадмий | Cd | 321,07 ℃ | 767 ℃ | |
| Рубидий | Rb | 39,3 ℃ | 688 ℃ | |
| Галлий | Ga | 29,76 ℃ | 2204 ℃ | |
| Индий | In | 156,6 ℃ | 2072 ℃ | |
| Таллий | Tl | 304 ℃ | 1473 ℃ | |
| Литий | Li | 18,05 ℃ | 1342 ℃ |
Перечень металлов и их сплавов со средней температурой плавления и кипения границах от 600 до 1600 ℃:
| № п/п | Наименование металла или сплав | Его обозначение на латинском | Температура плавления | Температура кипения |
| Алюминий | Al | 660 ℃ | 2519 ℃ | |
| Германий | Ge | 937 ℃ | 2830 ℃ | |
| Магний | Mg | 650 ℃ | 1100 ℃ | |
| Серебро | Ag | 960 ℃ | 2180 ℃ | |
| Золото | Au | 1063 ℃ | 2660 ℃ | |
| Медь | Cu | 1083 ℃ | 2580 ℃ | |
| Железо | Fe | 1539 ℃ | 2900 ℃ | |
| Кремний | Si | 1415 ℃ | 2350 ℃ | |
| Никель | Ni | 1455 ℃ | 2913 ℃ | |
| Барий | Ba | 727 ℃ | 1897 ℃ | |
| Бериллий | Be | 1287 ℃ | 2471 ℃ | |
| Нептуний | Np | 644 ℃ | 3901,85 ℃ | |
| Протактиний | Pa | 1572 ℃ | 4027 ℃ | |
| Плутоний | Pu | 640 ℃ | 3228 ℃ | |
| Актиний | Ac | 1051 ℃ | 3198 ℃ | |
| Кальций | Ca | 842 ℃ | 1484 ℃ | |
| Радий | Ra | 700 ℃ | 1736,85 ℃ | |
| Кобальт | Co | 1495 ℃ | 2927 ℃ | |
| Сурьма | Sb | 630,63 ℃ | 1587 ℃ | |
| Стронций | Sr | 777 ℃ | 1382 ℃ | |
| Уран | U | 1135 ℃ | 4131 ℃ | |
| Марганец | Mn | 1246 ℃ | 2061 ℃ | |
| Константин | 1260 ℃ | |||
| Дуралюмин — Сплав алюминия, магния, меди и марганца | 650 ℃ | |||
| Инвар — Сплав никеля и железа | 1425 ℃ | |||
| Латунь — Сплав меди и цинка | 1000 ℃ | |||
| Нейзильбер — Сплав меди, цинка и никеля | 1100 ℃ | |||
| Нихром — Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 ℃ | |||
| Сталь Сплав железа и углерода | 1300-1500 ℃ | |||
| Фехраль Сплав хрома, железа, алюминия, марганца и кремния | 1460 ℃ | |||
| Чугун Сплав железа и углерода | 1100-1300 ℃ |
Перечень металлов, плавка которых очень затруднительна – тугоплавких (больше ℃):
| № п/п | Наименование металла | Его обозначение на латинском | Температура плавления | Температура кипения |
| Вольфрам | W | 3420 ℃ | 5555 ℃ | |
| Титан | Ti | 1680 ℃ | 3300 ℃ | |
| Иридий | Ir | 2447 ℃ | 4428 ℃ | |
| Осмий | Os | 3054 ℃ | 5012 ℃ | |
| Платина | Pt | 1769,3 ℃ | 3825 ℃ | |
| Рений | Re | 3186 ℃ | 5596 ℃ | |
| Хром | Cr | 1907 ℃ | 2671 ℃ | |
| Родий | Rh | 1964 ℃ | 3695 ℃ | |
| Рутений | Ru | 2334 ℃ | 4150 ℃ | |
| Гафний | Hf | 2233 ℃ | 4603 ℃ | |
| Тантал | Ta | 3017 ℃ | 5458 ℃ | |
| Технеций | Tc | 2157 ℃ | 4265 ℃ | |
| Торий | Th | 1750 ℃ | 4788 ℃ | |
| Ванадий | V | 1910 ℃ | 3407 ℃ | |
| Цирконий | Zr | 1855 ℃ | 4409 ℃ | |
| Ниобий | Nb | 2477 ℃ | 4744 ℃ | |
| Молибден | Mo | 2623 ℃ | 4639 ℃ | |
| Карбиды гафния | 3890 ℃ | |||
| Карбиды ниобия | 3760 ℃ | |||
| Карбиды титана | 3150 ℃ | |||
| Карбиды циркония | 3530 ℃ |
Пользуясь представленной в таблицах информацией, можно легко узнать при какой температуре металл теряет свою твердость, превращается в жидкое или газообразное вещество. Эти данные нужны, чтобы определить возможность применения металлов или их сплавов в тех или иных отраслях, для решения определенных задач, и узнать, что необходимо для обеспечения обработки металла.
Информация необходима для обработки металла, создания из него тех или иных полезных человеку изделий, обеспечения их долговечности, улучшения эксплуатационных качеств.
- Автор: Виталий Данилович Орлов
- Распечатать
https://mdmetalla.ru/metall/kakoj-iz-etih-metallov-mozhet-plavitsya-v-ruke-cheloveka.html