Что такое полупроводник
Строение кристаллов полупроводников отличается правильными ковалентными связями, поэтому идеальный представитель этого класса материалов не способен проводить электрический ток. Но повышение температуры или облучение способствует отрыву электрона от атома и он становится носителем тока. Поэтому, пытаясь объяснить, что такое полупроводники простыми словами, можно сказать, что это материалы, способные изменять свои электрические свойства.

Особенности полупроводников
Отличительные особенности полупроводников
К полупроводникам относятся вещества и материалы, величина удельной электрической проводимости которых лежит в широком диапазоне: от 10 -10 до 10 4 Ом -1 × м -1 . Полупроводниковые материалы находятся между металлами (σ = 10 4 –10 6 Ом -1 × м -1 ) и диэлектриками (σ = 10 4 –10 6 Ом -1 × м -1 ).

Шкала удельных проводимостей
Ключевое отличие полупроводников от металлов заключается в том, что повышение температуры вызывает увеличение их электропроводности. Ещё одним уникальным свойством является высокая чувствительность к воздействию внешнего излучения. Современная электронная промышленность (от простейших диодов и транзисторов до тиражирования больших интегральных схем) полностью базируется на структурах, использующих электрофизические свойства полупроводников.
Историческая справка
Одним из первых на необычную температурную зависимость сульфида серебра (Ag2S) обратил внимание выдающийся британский физик-экспериментатор М. Фарадей. Электрическое сопротивление этого соединения, имеющего в своём составе значительную долю серебра и считавшегося в то время металлом, при нагревании падало. С 1833 г. по 1838 г. М. Фарадей обнаружил ещё пять веществ с аналогичными свойствами (сульфид ртути HgS, фторид свинца PbF2 и ряд других).

Физики, открывшие фундаментальные свойства полупроводников
Кроме экспериментов Фарадея, основными вехами в развитии области исследования полупроводников были следующие открытия:
- Обнаружение немецким учёным Т. И. Зеебеком эффекта возникновения термо-ЭДС, возникавшей при помещении двух спаев разнородных проводников (термопара) в различные температурные условия. Эффект удалось объяснить только с помощью общей теории полупроводниковых переходов в ХХ в.
- В 1873 г. английский инженер-электрик У. Смит обнаружил высокую чувствительность селена (Se) к падающему на него освещению. Селен в виде стекловидной массы предполагалось использовать в качестве изоляции для подводного телеграфного кабеля. На свету сопротивление селеновой изоляции резко падало. Было установлено, что селен реагирует даже на небольшой световой поток Луны.
- В 1874 г. немецкий учёный Ф. Браун обнаружил диодный (вентильный) эффект, когда контакт сернистого свинца PbS имел малое сопротивление для одного направления протекающего тока и на несколько порядков большее для противоположного.

Эффект Зеебека
Изучая общие сведения о полупроводниках, можно сделать вывод, что эти материалы из-за своей удельной проводимости находятся между проводниками и диэлектриками. Их проводимость сильно зависит от температуры, различных видов излучения и концентрации примесей. Впервые определение «полупроводник» использовали в 1911 г. в своих работах немецкие физики Вейсс и Кенигсбергер. На немецком языке этот термин произносится как halbleiter, а на английском — semicoductor.
Физические свойства и характеристики полупроводников
Разгадать физические механизмы и построить математические модели, объясняющие электрические свойства полупроводников, исследователям удалось только в первой половине ХХ в. после разработки основ квантовой механики.
Зонная теория
Движение электронов в кристаллических структурах (металлах, полупроводниках, диэлектриках) описывается с помощью квантовой теории твёрдых сред. Согласно этой теории энергетический спектр электронов в кристаллах радикально отличается от непрерывного энергетического спектра свободных электронов или спектра электронов, расположенных в изолированных атомах (дискретные уровни с жёстко детерминированным набором разрешённых энергий). Этот спектр состоит из отдельных разрешённых энергетических зон, разделённых зонами запрещённых энергий.

Величина запрещённой зоны определяет величину удельного сопротивления и тип материала
Наивысшие из разрешённых зон энергии в диэлектриках и полупроводниках называются валентными. В них при Т=0° К все уровни энергии заняты электронами. По другую сторону запрещенных зон располагаются так называемые зоны проводимости. В металлах (проводниках) зона проводимости — это наивысшая разрешённая зона, где располагаются электроны при Т=0° К. Именно по этому принципу, задающему взаимное расположение энергетических зон, все твердые материалы разделяют на три основные группы:
- Металлы — запрещённая зона ΔЕ = 0.
- Полупроводники — ΔЕ < 3 эВ.
- Диэлектрики — ΔЕ > 3 эВ.
Электрон-вольт — это внесистемная единица энергии, 1 эВ = 1.602×10 -19 Дж.
Электронно-дырочная проводимость
Для объяснения, какие вещества называют полупроводниками, а также моделирования электрических и оптических процессов, происходящих в них, оказалось очень плодотворным введение понятия о дырочной проводимости наряду с электронной. Например, в кремнии и германии связь между атомами ковалентная (электроны соседних атомов образуют «родственные», связующие пары). Для создания проводимости требуется разрыв, как минимум, одной из связей, после чего электрон переместится в место, где все связи «укомплектованы», поэтому одинокий электрон является избыточным, перемещаясь внутри кристалла. Тем самым он становится переносчиком отрицательного заряда и превращается в электрон проводимости.
Ранее разорванная связь превращается в перемещающуюся по кристаллу «дырку» в силу того, что один из соседних электронов занимает образовавшееся вакантное место. Отсутствие электрона у одной из ковалентных связей означает появление дырки — квазичастицы с положительным зарядом. Чтобы образовалась пара электрон-дырка требуется затратить энергию, необходимую для преодоления запрещённой зоны. Например, для кремния ΔЕ = 1.1 эВ, для германия ΔЕ = 0.66 эВ.

Электроны и дырки
В идеальном (чистом) полупроводнике число электронов всегда в точности равно числу дырок. Для создания слоёв с разными типами проводимости в полупроводниковые материалы внедряются легирующие примеси, которые делятся на доноры и акцепторы:
- Доноры, будучи 5-валентными, при вступлении в ковалентную связь теряют один электрон, который становится свободным носителем электрозаряда. Использование донорных примесей позволяет создавать n-типы полупроводников (n — negative) c электронной проводимостью.
- Акцепторы, будучи 3-валентными, увеличивают концентрацию дырок, после чего полупроводник становится p-типа (p — positive) c дырочной проводимостью.
Комбинируя p и n слои на одной пластине физики научились создавать p-n-переходы, ставшие основой для полупроводниковых диодов, транзисторов, тиристоров, микросхем.

Доноры и акцепторы
Виды современных полупроводников
На сегодняшний день найдено и изучено большое количество веществ, обладающих полупроводниковыми свойствами. В общем виде классификация полупроводников учитывает их основные свойства и подразумевает две основные группы материалов:
- Простые полупроводники — химические элементы из таблицы Менделеева: германий (Ge), сурьма (Sb), кремний (Si), углерод (C), селен (Se), бор (B), сера (S), йод (I), теллур (Te). Широко применяются кремний, германий и селен. Остальные вещества используются в качестве легирующих примесей или как компоненты, входящие в состав сложных полупроводников.
- Сложные полупроводники — это материалы, состоящие из нескольких химических элементов (из двух, трёх и более). Примеры полупроводников данного типа: бинарные соединения с мышьяком — арсениды, с серой — сульфиды, с углеродом — карбиды, с теллуром — теллуриды. Виды сложных полупроводников выделяют по принадлежности компонентов соединения к группам таблицы Менделеева и обозначают заглавными латинскими буквами (первый элемент — А, второй — В). Например, в электронной промышленности нашли широкое применение такие соединения А III В V , как InSb, GaP, InAs, InP, GaSb, AlSb, GaN, InN.

Типы полупроводников
Электронные устройства на основе полупроводников
Следует отметить, что свойства полупроводниковых материалов изучены намного лучше, чем свойства металлов и диэлектриков. Это связано с их широким применением в радиоэлектронике. Полупроводниковые приборы, если говорить кратко, являются основным стимулом изучения полупроводников.
Устройства на основе p-n-переходов
Свойства полупроводниковых материалов, структура которых строится на различных комбинациях слоев с электронной и дырочной проводимостью, стали основой электронных компонентов, используемых для управления и преобразования электрических и оптических сигналов. Это такие радиоэлектронные элементы, как:
- Диоды.
- Биполярные транзисторы.
- Полевые (МДП-транзисторы).
- Тиристоры.
- Варикапы.
- Стабилитроны (диоды Зенера).
- Фотодиоды.
- Солнечные батареи.
- Светодиоды.
- Стабисторы.
- PIN-диоды.
- Туннельные диоды.
- Полупроводниковые лазеры.

Полупроводниковые устройства
Микросхемы
В отдельный класс можно выделить микросхемы, которые на одной кремниевой пластине могут объединять сотни тысяч отдельных элементов, выполняющих работу аналоговых или цифровых устройств.

Микросхемы
Гетероструктуры
Одним из самых ярких достижений в области физики полупроводником является создание гетероструктур. Полупроводники гетероструктурного типа — это слоистые сэндвич-структуры из различных материалов, отличающихся шириной запрещённой зоны.

Гетероструктуры
За создание гетероструктур российскому физику Жоресу Алфёрову в 2000 г. была присуждена Нобелевская премия.

Жорес Алфёров — создатель гетероструктур
Сферы применения
На сегодняшний день применение полупроводников довольно широкое. Они являются основной элементной базой для приборов гражданского (коммерческого) и специального назначений, таких как компьютеры, смартфоны, теле- и видеотехника. Современные транспортные средства буквально «напичканы» полупроводниковыми микросхемами, оптимизирующими массу параметров двигателя и прочих систем автомобилей, самолетов и поездов.
Полупроводники и их свойства позволили полностью осуществить замену громоздких вакуумных, электронных ламп на компактные, ударопрочные устройства. С помощью тысяч транзисторов, размещённых на одной кремниевой пластине, инженеры-электронщики создают универсальные, программируемые микросхемы: операционные усилители, процессоры, карты памяти и другие устройства. Физические и оптические свойства полупроводников позволили создать фотоприёмники, светодиоды, приборы ночного видения, полупроводниковые лазеры.
Страны с развитыми экономиками продолжают инвестировать огромные средства в исследования, в ходе которых создаются новые полупроводниковые материалы и структуры.
Видео по теме
14 различных типов металлов

Термин «металл» происходит от греческого слова «metalléuō», что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы — это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы — это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин «железо» происходит от латинского слова «Ferrum», что переводится как «железо». Таким образом, термин «черный металл» обычно означает «содержащий железо», тогда как «цветной металл» означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы — это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель — для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро — второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов — использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
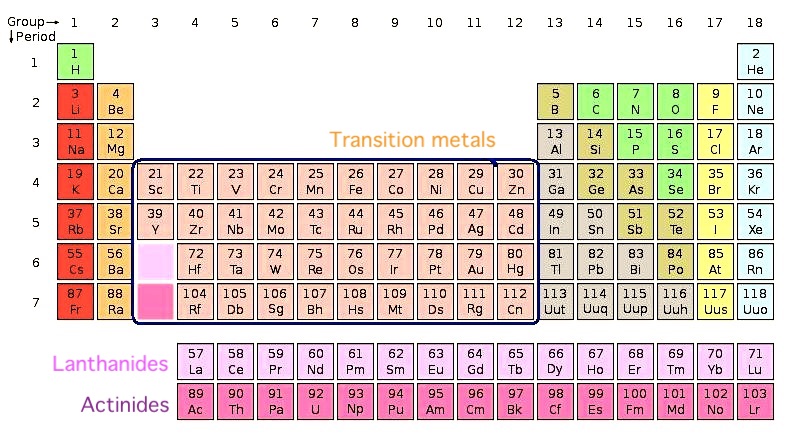
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице — это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются «бедными» или «другими» металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий — в топливных элементах и полупроводниках.
2. Лантаноиды

Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды — это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды — это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
https://profazu.ru/knowledge/electronics/poluprovodniki-eto.html
