Способы получения металлов. (11 класс) презентация
Способы получения металлов обычно разделяют на три типа: пирометаллургические — восстановление при высоких температурах; гидрометаллургические — восстановление из солей в растворах; электрометаллургические — электролиз раствора или расплава.
- Главная
- Химия
- Способы получения металлов. (11 класс)
Слайд 1Основные способы получения металлов
Урок в 11 классе

Слайд 2Способы получения металлов
обычно разделяют на три типа:
пирометаллургические — восстановление при
высоких температурах;
гидрометаллургические — восстановление из солей в растворах;
электрометаллургические — электролиз раствора или расплава.

Слайд 3Пирометал-лургически
получают: чугун, сталь, медь, свинец, никель, хром и другие металлы.
процесс –
получение стали и чугуна

Слайд 4Гидрометаллургически получают: золото, цинк, никель и некоторые другие металлы.
Получаемые металлы: Cd,
Ag, Au, Cu, Zn, Mo и др.

Слайд 5Электрометал-лургически получают: щелочные и щёлочноземель-ные металлы, алюминий, магний и другие металлы.

Слайд 6Общие способы получения металлов
1. Восстановление металлов из оксидов углем или угарным газом
MеxOy +
MеxOy + C = CO + Me,
MеxOy + CO = CO2 + Me
получают: Fe, Cu, Pb, Sn, Cd, Zn
Например,
1. ZnOy+ C t= CO + Zn
2. Fe3O4+ 4CO t= 4CO2 + 3Fe
3. MgO + C t= Mg + CO
Не подходит для металлов, образующих карбиды с углём.

Слайд 7Общие способы получения металлов
2. Обжиг сульфидов с последующим восстановлением (если металл находится
в руде в виде соли или основания, то последние предварительно переводят в оксид)
1 стадия –
MеxSy+O2 = MеxOy+SO2
2 стадия –
MеxOy + C = CO2 + Me или
MеxOy + CO = CO2 + Me
1. 2ZnS + 3O2 t= 2ZnO + 2SO2↑
2. MgCO3 t= MgO + CO2↑

Слайд 8Общие способы получения металлов
3 Алюмотермия (в тех случаях, когда нельзя восстановить углём или
угарным газом из-за образования карбида или гидрида)
MеxOy + Al = Al2O3 + Me
получают: Mn, Cr, Ti, Mo, W, V и др
Например,
1. 4SrO + 2Al t= Sr(AlO2)2 + 3Sr
2. 3MnO2 + 4Al t= 3Mn + 2Al2O3
3. 2Al + 3BaO t= 3Ba + Al2O3 (получают барий высокой чистоты)

Слайд 9Общие способы получения металлов
4. Водородотермия — для получения металлов особой чистоты
Получают металлы большей чистоты: Cu, Ni, W, Fe, Mo, Cd, Pb
Например,
1. WO3 + 3H2 t= W + 3H2O↑
2. MoO3 + 3H2 t= Mo + 3H2O↑

Слайд 10Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов
солей (хлоридов):
2NaCl расплав, электр. ток. 2 Na + Cl2↑
CaCl2 расплав, электр. ток. Ca + Cl2↑
расплавов гидроксидов:
4NaOH расплав, электр. ток. 4Na + O2↑ + 2H2O
(. используют изредка для Na)

Слайд 11Восстановление металлов электрическим током (электролиз)
Б) Алюминий в промышленности получают в результате электролиза расплава
оксида алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3 расплав в криолите, электр. ток. 4Al + 3 O2↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO4+2H2O раствор, электр. ток. 2Cu + O2 + 2H2SO4

Слайд 12
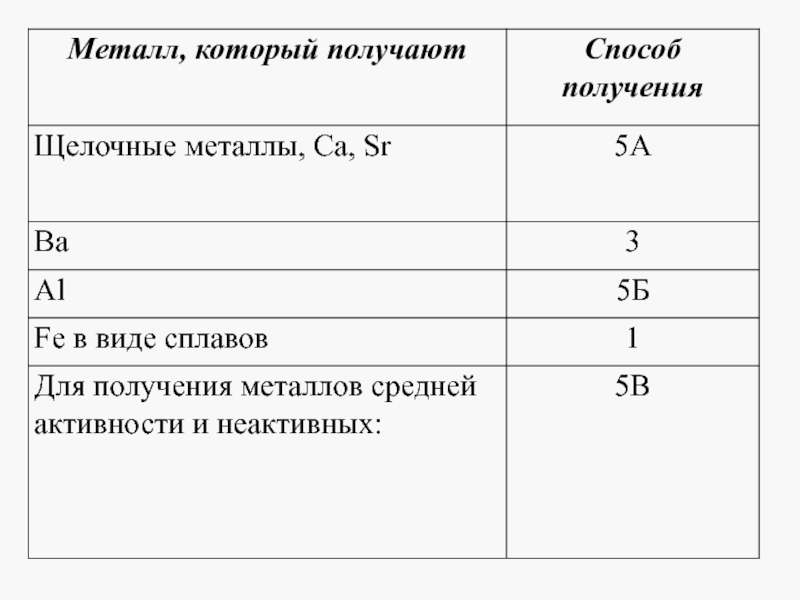
Слайд 13Примеры заданий по теме: «Общие способы получение металлов»
Задания с выбором ответа
( А10, А24, А29).
А1. Реакция возможна между
1) Ag и K2SO4 (р-р)
2) Zn и KCl (р-р)
3) Mg и SnCl2 (р-р)
4) Ag и CuSO4 (р-р)
А2. Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg

Слайд 14A3. Какой из металлов вытесняет медь из сульфата меди (II)?
1) Zn 2) Ag 3) Hg 4) Au
A4. Формула вещества, восстанавливающего оксид меди (II) — это
1) CO2 2) H2 3) HNO3 4) Cl2
A5. Формула вещества, не восстанавливающего оксид железа (III) —
1) HCl 2) Al 3) H2 4) C

Слайд 15А6. Для осуществления превращений в соответствии со схемой:
Al(OH)3 → AlCl3 → Al необходимо последовательно использовать
1) хлор и водород
2) хлорид натрия и водород
3) хлороводород и цинк
4) соляную кислоту и калий
А7. Пирометаллургический метод получения металлов отражает реакция:
1) HgS + O2 → Hg + SO2
2) CuSO4 + Fe → FeSO4 + Cu
3) 2NaCl (ток)→ 2Na + Cl2
4) CuSO4 + Zn → ZnSO4 + Cu

Слайд 16А8. Гидрометаллургический метод получения металлов отражает реакция:
1)
HgS + O2 → Hg + SO2
2) CuSO4 + Fe → FeSO4 + Cu
3) 2NaCl (ток)→ 2Na + Cl2
4) AlCl3 + 3K → Al + 3KCl
А9. В качестве восстановителя при выплавке железа в промышленности
наиболее часто используют
1) водород
2) алюминий
3) натрий
4) кокс

Слайд 17А10. Оксид углерода (II) проявляет восстановительные свойства при нагревании с
1)
N2 2) H2S 3) Fe 4) Fe2O3
Задания с кратким ответом (В3)
В1. При электролизе раствора AgNO3 на катоде выделяется
1) серебро
2) водород
3) серебро и водород
4) кислород и водород

Слайд 18В2. Установите соответствие между формулой вещества и продуктом электролиза его водного
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) AgF 1) Ag, F2
Б) NaNO3 2) Ag, O2, HF
B) Pb(NO3)2 3) H2, O2
Г) NaF 4) Pb, O2, HNO3
5) H2, NO2, O2
6) NaOH, H2, F2

Слайд 19В3. Установите соответствие между формулой вещества и продуктом электролиза его водного
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА ВОДНОГО РАСТВОРА
А) HgCl2 1) металл, хлор
Б) AlCl3 2) водород, хлор, гидроксид
В) Hg(ClO4)2 металла
Г) Na2SO3 3) водород, кислород
4) металл, кислород, кислота
5) металл, сернистый газ
6) водород, сернистый газ

Слайд 20В4. Установите соответствие между формулой вещества и продуктом электролиза его водного
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) нитрат цинка 1) цинк, кислород, азотная кислота
Б) бромид цинка 2) водород, кислород
В) бромид калия 3) водород, оксид азота (IV)
Г) нитрат калия 4) цинк, бром
5) водород, бром, гидроксид калия
6) калий, бром
7) калий, оксид азота (IV)

Слайд 21В5. Установите соответствие между формулой вещества и продуктом электролиза его водного
раствора, образующимся на като-де
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) Li2SO4 1) H2
Б) Ba(OH)2 2) O2
В) MgCl2 3) Cl2
Г) SnCl2 4) Li
5) Ba
6) Mg
7) Sn

Слайд 22В6. Верны ли следующие суждения о промышленных способах получения металлов?
А.
В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны

Слайд 23В7. Установите соответствие между металлом и способом его
электролитического получения.
МЕТАЛЛ ЭЛЕКТРОЛИЗ
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплав-
ленном криолите
6) расплавленного нитрата

Слайд 24В8. Установите соответствие между металлом и способом его электролитического получения.
МЕТАЛЛ ЭЛЕКТРОЛИЗ
А) калий 1) расплавленного нитрата
Б) магний 2) водного раствора гидроксида
В) медь 3) расплава хлорида
Г) свинец 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) водного раствора солей

Слайд 25В9. Установите соответствие между металлом и способом его электролитического получения.
МЕТАЛЛ ЭЛЕКТРОЛИЗ
А) хром 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) литий 3) расплава соли
Г) барий 4) расплавленного оксида
5) раствора оксида в расплав-
ленном криолите
6) расплавленного нитрата

Слайд 26Задания с развёрнутым ответом (С2)
С1. Напишите уравнения реакций, с помощью которых
можно осуществить превращения:
Cu → Cu(NO3)2 → Cu(OH)2 → Х → Сu → CuSO4
Укажите условия протекания реакций.
C2. Даны вещества: алюминий, оксид марганца (IV), водный раствор сульфата меди и концентрированная соляная кислота.
Напишите уравнения четырёх возможных реакции между этими веществами.
Способы получения металлов и их уравнения реакций

Понятие о металлургии: общие способы получения металлов
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
Видео: Получение металлов. 9 класс. Скачать

1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
| Нахождение металлов в природе | ||
| Активные металлы — в виде солей | Металлов средней активности — в виде оксидов и сульфидов | Малоактивные металлы -в виде простых веществ |
| Хлорид натрия NaCl | ||
Видео: Химия 11 класс (Урок№10 — Общая характеристика и способы получения металлов.) Скачать

2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
Видео: Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 класс Скачать

3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
Видео: Химия 9 класс : Получение металлов Скачать

3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
Видео: Составление уравнений химических реакций. 1 часть. 8 класс. Скачать

3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.

Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
Видео: Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 класс Скачать

3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.

Например , железо можно получить восстановлением из оксида с помощью угарного газа:
Видео: Химические свойства металлов. 9 класс. Скачать

3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:

Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Видео: Способы получения металлов Скачать

3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
Видео: Общая характеристика и способы получения металлов Скачать

4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
CaO + SiO2 → CaSiO3
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Видео: СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и Металлами Скачать

Способы получения металлов и их уравнения реакций
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Видео: ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солями Скачать

Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.

В соответствии с этим существуют следующие способы получения металлов:
Видео: Проклятая химическая реакция 😜 #shorts Скачать

Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);

Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Видео: Нахождение металлов в природе. Способы получения металлов Скачать

Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Видео: Сплавы металлов. 9 класс. Скачать

Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
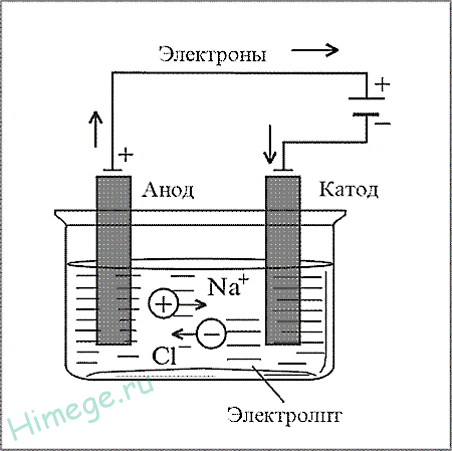
а) NaCl (электролиз расплава) → 2Na + Cl2
Видео: Химические способы получения металлов Скачать

Химия. 11 класс
Конспект урока
Урок № 10. Общая характеристика и способы получения металлов
Перечень вопросов, рассматриваемых в теме: урок посвящён веществам, которые относят к группе металлов, и их взаимодействиям. В ходе урока школьники познакомятся с общими способами получения металлов.
Алюмотермией называют реакции, протекающие между оксидами металлов и алюминием, с образованием соответствующего свободного металла и оксида алюминия.
Гидрометаллургия — вытеснение металлов из руд с помощью растворов различных реагентов без применения высоких температур.
Катион – положительно заряженный ион, который притягивается к катоду в процессе электролиза.
Кристаллическая решётка вещества – это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства.
Ко́вкость – способность металлов и сплавов подвергаться изменению при обработке давлением.
Магниетерми́я – метод металлотермии, процесс восстановления элементов из их оксидов, хлоридов, фторидов магнием.
Металлическая связь – химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов – алюминия, магния.
Пласти́чность — свойство твердых тел необратимо деформироваться при действии механических нагрузок.
Теплопрово́дность – способность материальных тел проводить энергию (теплоту) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.).
Электро́лиз – физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ.
Эле́ктроотрица́тельность – количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Электропроводность – способность тела или среды проводить электрический ток, определяющее возникновение в них электрического тока под воздействием электрического поля.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
На сегодняшний день известно 118 элементов, 96 из которых являются металлами. Открыты и исследованы они были в разное время.
Химические элементы по времени открытия
🔍 Видео
КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и Металлами Скачать

Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина Строганова Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и Получение Скачать

Металлы. Тема 38. Химические способы получения металлов Скачать
https://thepresentation.ru/himiya/sposoby-polucheniya-metallov-11-klass