Обратимые и необратимые термодинамические процессы
Термодинамика является наукой об энергии и ее функциях. Термодинамика объясняет закономерность переходов энергии в различные формы. Основу термодинамики составляют законы способные объяснить эффект теплового превращения энергии. Ученые этой области работают над возможностью усовершенствования тепловых машин и повышения их коэффициента полезного действия. Эта статья расскажем Вам о таких разделах термодинамики, как обратимые и необратимые процессы, энтальпия и энтропия.
Обратимые и необратимые процессы
Все протекающие физические процессы делятся на обратимые и необратимые. Если процесс может быть выполнен через одни и те же промежуточные состояния, но в обратном направлении, он является обратимым. При этом важным условием обратимости является отсутствие изменений в окружающей систему среде при таких переходах. Если переход невозможен или наблюдаются изменения в окружающей среде или самой системе, то процесс необратим. При необратимом процессе система не сможет вернуться в точку исходного состояния.

Обратимые процессы
В природе не существует обратимых термодинамических процессов. Однако, при изучении широко используют понятие обратимого процесса. Все циклы, описанные в учебниках, обратимы. Примером таких процессов является цикл Карно. Он может протекать как в прямом, обратном направлении.
Прямой цикл Карно
Прямой цикл Карно в pV координатах представлен ниже. Подробное описание цикла Карно Вы можете найти прочитав статью.

Обратный цикл Карно
Обратный цикл Карно в pV координатах представлен ниже. На его основе осуществляется работа холодильных установок. Подробное описание обратного цикла Карно Вы можете найти прочитав статью.

Обратимые — это процессы, которые могут протекать в прямом и обратном направлении. Термодинамическая система переходит из одного состояния в другое и обратно. При этом, переход не вызывает влияния на окружающую систему среду. Окружающая среда не претерпевает изменений.
Определение обратимости, которое мы дали, является наиболее распространенным. Часто встречается более узкое определение:
Процесс считается обратимым, если он может быть обращен вспять с бесконечно малыми изменениями в окружающей среде на каждом этапе.
Основываясь на этом определении, квазистатический процесс является обратимым.
Квазистатический — процесс протекающий так медленно, что его можно принять за статический.
Примеры обратимых процессов
- Изотермическое расширение. Примером обратимого процесса является изотермическое расширение рабочего тела в цикле Карно. Изотермическое расширение может протекать и обратную сторону. В таком случае, это уже будет процесс изотермического сжатия.
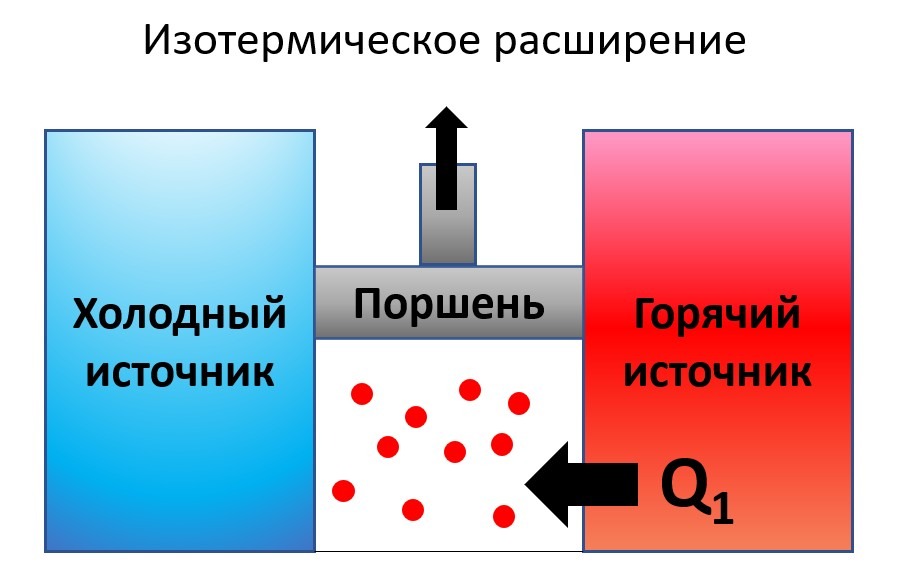
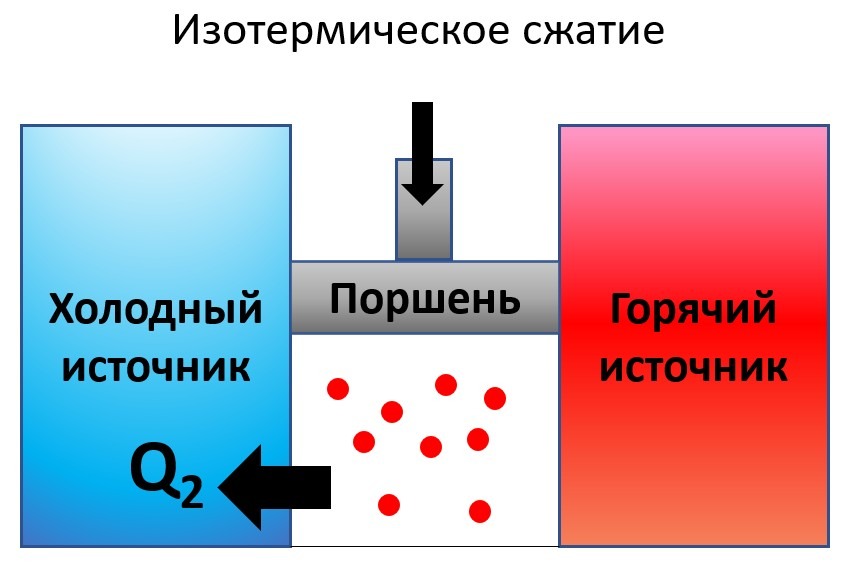
- Идеальное колебание маятника. Идеальный механический процесс, протекающий без трения, может быть обратимым. Примером такого является колебание тяжелого маятника. При очень длинном маятнике амплитуда колебаний остается практически неизменной длительное временя. Если сопротивление среды достаточно низкое, то кинетическая энергия колебательного маятника полностью преобразуется в его потенциальную энергию и наоборот. Колебания повторяются до бесконечности и являются обратимыми.

Необратимые процессы
Процесс считается необратимым, если при возврате системы к исходному состоянию на окружающей систему среде отражаются результаты этого процесса. Это могут быть потери теплоты при протекании термодинамических процессов или потери энергии за счет трения. Большинство процессов, сопровождающих нашу жизнь, являются необратимыми.
Процесс можно назвать необратимым, если он протекает неконтролируемо и в одном направлении.
Направление необратимых процессов невозможно изменить, не нарушив порядок пройденных промежуточных состояний.
Только при обратимом процессе возможен самопроизвольный возврат системы в начальное состояние. То есть, совершенной работы в процессе достаточно чтобы вернутся в исходную точку.
Например, возвращение идеального маятника в точку, из которой он был отпущен вначале. Поэтому, степенью или мерой необратимости любого процесса можно назвать величину работы или затраченной энергии для возвращения системы в исходное состояние. Под мерой необратимости понимают величину любого внешнего воздействия на систему со стороны окружающей её среды.
Примеры необратимых процессов
- Диффузия. Диффузия – взаимное проникновение частиц нескольких соприкасающихся веществ или тел друг в друга. Этот процесс может протекать только в одном направлении. Невозможно, без приложения внешнего воздействия, разделить смешанные вещества.

- Теплопроводность. Передача теплоты может протекать только от горячих тел к холодным. Обратный процесс возможен только за счет затрачивания энергии со стороны.

- Трение. Преобразование кинетической энергии в тепло, т.е. во внутреннюю энергию системы, через трение является необратимым процессом. Посредством трения, часть работы превращается в тепло, рассеивается, и следы остаются на окружающей среде, поэтому процесс трения считают необратимым.

Все реальные процессы осуществляются с предельной скоростью. Во время этих процессов возникают силы трения, теплообмена и диффузии. Очевидно, что все они необратимы.
«Прямой» необратимый процесс протекает сам по себе, и для того, чтобы система вернулась в исходное состояние, необходимо изменение внешней среды – внешнее воздействие. Необратимые процессы невозможно изобразить на термодинамической диаграмме.
Простым примером необратимого процесса, часто рассматриваемого в термодинамике, является передача тепла от нагретого тела к холодному.
Обратимые и необратимые циклы
Циклы — это термодинамические процессы, при которых система возвращается в исходное состояние. Если все составляющие цикл процессы обратимы, то и цикл называется обратимым. И если хотя бы один процесс цикла необратим, то такой цикл считается необратимым.
Обобщая, можно выделить следующую классификацию обратимых процессов:
- механические без трения скольжения,
- электромагнитные колебания
- квазистатические термодинамические процессы.
- все механические с передачей тепла,
- все процессы с диффузией
- действительные процессы протекающие с трением
- передача тепла от более нагретого тела к менее нагретому телу.
Энтропия и энтальпия
В этом разделе описаны важнейшие понятия термодинамики — энтропия и энтальпия.
Что такое энтропия?
Энтропия – мера хаотичности термодинамической системы. При протекании самопроизвольно процесса энтропия изолированной системы увеличивается Δs>0. Это обусловлено Вторым законом термодинамики.
В широком смысле, это слово часто используется в повседневной жизни. Энтропия означает меру беспорядка или случайности системы.
Энтропия — это мера беспорядка, также является одной из характеристик состояния системы.
Чтобы понять, что такое энтропия, можно визуально представить любые объекты в пространстве. Например, шары на бильярдном столе. Когда все шары располагаются в одном месте в треугольнике, энтропия системы «стол-шары» минимальна. После удара битком, шары разлетаются по столу и занимают случайное, хаотичное положение. Можно сказать, что произошло увеличение энтропии системы.


Увеличение энтропии характеризует увеличение равномерности распределения параметров системы. Чем более равномерно вещи размещены в определенном пространстве, тем больше энтропия. Проще говоря, энтропия — это разница состояний, например холодное и горячее, темное и светлое, жидкое и твердое.

Всё стремится к равновесию, вся вселенная стремится к одному состоянию, одной температуре, одному агрегатному состоянию, одной плотности, одной энергии и т.д. То есть, максимальная энтропия будет при абсолютно одинаковом состоянии всего.
Второе начало термодинамики говорит о том, что в изолированной системе энтропия не может уменьшаться самопроизвольно. Энтропия в изолированной системе самопроизвольно увеличивается.

Например, передача тепла от более нагретого тела к менее нагретому проходит самопроизвольно. Чтобы передать тепло от менее нагретого тела к более нагретому, нужно затратить энергию. То есть, совершить работу. Об этом и говорит Второй закон термодинамики. Этот закон заложен в основу работы холодильных машин и тепловых насосов.
Что такое Энтальпия?
Энтальпия — это функция состояния системы, характеризующая термодинамический потенциал или теплосодержание. Энтальпия описывает состояние системы в термодинамическом равновесии и является функцией других независимых переменных. К таким переменным относятся: давление, энтропия, температура и т.д.
Энтальпия — это энергия, которая может преобразоваться в теплоту при определенном давлении. Единица измерения энтальпии кДж/кг – показывает сколько кДж энергии содержит каждый кг рабочего тела.
С помощью энтальпии определяют изменения энергии происходящие в системе. Когда к системе подводится энергия или она нагревается – энтальпия системы возрастает. И наоборот, при выделении тепла системой, то есть охлаждении, её энтальпия уменьшается.

Понять, как это работает можно на повседневном примере. При нагреве воды в чайнике ее температура растет, пока не достигнет температуры кипения. В этом случае энтальпия непрерывно возрастает, так как к воде подводится энергия извне. После, оставив эту воду остывать, энтальпия будет снижаться. Энергия воды при остывании будет выделяться в окружающую среду.
Во время протекания химических процессов происходит поглощение либо выделение теплоты. Поглощение теплоты будет являться эндотермическим процессом, а выделение экзотермическим. Изменение энтальпии будет измерять количество теплоты в протекающем процессе, это значение будет равно обмену тепла при постоянном давлении.
Заключение
- обратимый процесс возможен только в теории
- скорость протекания данного процесса должна быть ниже скорости формирования состояния равновесия.
Энтропия характеризует меру беспорядка системы. Все реальные процессы протекают с увеличением энтропии.
Энтальпия — это энергия, отнесенная к единице массы. То есть, это термодинамический потенциал.
Энтропия — это энергия, отнесенная к одному Кельвину.
Прямое восстановление железа

Прямое восстановление железа — это восстановление железа из железной руды или окатышей с помощью газов (СО, Н2, NH3), твердого углерода, газов и твердого углерода совместно. Процесс ведется при температуре около 1000 °C, при которой пустая порода руды не доводится до шлакования, примеси (Si, Mn, P, S) не восстанавливаются, и металл получается чистым. В литературе также встречаются термины: металлизация (частичная металлизация) руд, прямое получение железа, бездоменная (внедоменная) металлургия железа, бескоксовая металлургия железа. Продукт процесса называют железом прямого восстановления (DRI от англ. Direct Reduced Iron).
История
Попытки получить сталь минуя доменный процесс предпринимались в СССР ещё в 1950-х годов. Промышленное производство железа непосредственно из руды, минуя доменный (с использованием кокса) процесс, появилось в 1970-х годах. Первые установки прямого восстановления железа были малопроизводительны, а конечный продукт имел сравнительно много примесей. Широкое распространение этого процесса началось в 1980-х годах, когда в горно-металлургическом комплексе началось широкое применение природного газа, который идеально подошел для прямого восстановления железной руды. Кроме того, помимо природного газа, в процессе прямого восстановления железа оказалось возможным использование продуктов газификации углей (в частности бурых), попутного газа нефтедобычи и другого топлива-восстановителя.
Технологические изменения, произошедшие в 1990-е годы, позволили значительно снизить капитало- и энергоемкость различных процессов прямого восстановления железа, в результате чего произошел новый скачок в производстве продукции DRI (от англ. Direct Reduction of Iron).
Классификация процессов
Наиболее предпочтительной, по мнению большинства специалистов, является классификация по виду получаемого продукта:
- получение частично металлизованных (степень металлизации 30—50 %) материалов для доменных печей;
- получение высокометаллизованного продукта (степень металлизации 85—95 %) в твёрдом виде (губчатого железа) для переплавки в сталеплавильных агрегатах с получением стали;
- получение металлизованного продукта в пластическом состоянии (кричного железа) для различных целей, в том числе как вариант пирометаллургического обогащения труднообогатимых, бедных и комплексных руд;
- получение жидкого металла (чугуна или полупродукта) для переплава в сталеплавильных печах.
Сравнение с доменным процессом
Возможности переработки бедных железных руд
Доменный процесс обеспечивает получение кондиционного чугуна из железных руд с любым содержанием железа, при этом содержание железа влияет лишь на технико-экономические показатели процесса. Металлизация бедных руд может быть эффективна лишь для получения кричного железа и жидкого металла. Частично металлизованные материалы и губчатое железо получать из бедных руд неэффективно. При получении частично металлизованных материалов из бедных руд необходимо затратить большее количество тепла на нагрев пустой породы и увеличить расход восстановителя. Производство губчатого железа из руд, содержащих более 2,5—3,0 % пустой породы, приводит к резкому росту расхода электроэнергии в процессе плавки металлизованных окатышей из-за резкого увеличения количества шлака.
Наличие примесных элементов
Доменная печь в состоянии полностью обеспечить получение кондиционного по сере чугуна. Удаление из чугуна меди, фосфора, мышьяка в доменной печи невозможно. Низкотемпературные процессы получения губчатого железа не обеспечивают удаления попутных элементов, то есть все попутные элементы, присутствующие в исходной руде, остаются в губчатом железе и попадают в сталеплавильный агрегат. Это же относится к получению кричного металла (здесь возможна некоторая степень удаления серы). Получение жидкого металла позволяет удалить из процесса летучие элементы (цинк, щелочные металлы), а степень удаления серы, мышьяка и фосфора зависит от режима процесса.
Физические свойства руды
В доменной печи перерабатывают исключительно кусковой железорудный материал, причем размер кусков не должен быть менее 3—5 мм. Отсюда вытекает необходимость процесса окускования руд. Это требование остается обязательным для процессов получения губчатого и кричного железа в шахтных и вращающихся печах. Низкотемпературная металлизация измельченных руд возможна в специальных агрегатах (например, аппараты кипящего слоя). Для большинства способов внедоменного получения жидкого металла размер кусков руды не имеет значения, поэтому возможно исключение из металлургического передела дорогостоящих процессов окускования мелких руд.
Использование недефицитных видов топлива
Современные доменные печи в качестве топлива используют только металлургический кокс. Прежде всего это связано с высокими прочностными качествами кокса, сохраняющимися при высоких температурах. Ни один из известных ныне (2007 год) видов твёрдого топлива не может в этом отношении конкурировать с коксом. Большинство известных способов и технологий металлургии железа не требуют использования кокса в качестве компонента шихты. Могут быть использованы полученные различным способом восстановительные газы (в основном при производстве губчатого железа), недефицитные виды каменного угля, бурые угли и продукты их переработки, нефтепродукты и др.
Использование новых видов энергии
Несмотря на то что использование энергии плазмы, атомной и других новых источников энергии для доменного производства не исключается, наибольший эффект от их применения наблюдается при внедоменном получении металла. Это повышает шансы новых технологий в конкуренции с доменным процессом в будущем.
Технология
Процессы получения губчатого железа осуществляются при умеренных температурах с использованием газообразного или твердого восстановителя в различных агрегатах: шахтных, трубчатых, туннельных, муфельных, отражательных, электронагревательных печах, ретортах периодического действия, конвейерных машинах, реакторах с кипящим слоем и др. Иногда эти агрегаты соединены в комплексы, в которых наиболее часто сочетаются с электропечью (электродоменной или дуговой) для получения жидкого металла (чугуна и стали). Чаще всего губчатое железо применяют как высокочистую добавку к стальному лому. Наиболее стабильный спрос на губчатое железо отмечается в странах с недостаточными мощностями доменного производства и поставками стального лома.
Основными процессами, используемыми на работающих, строящихся и проектных установках для производства губчатого железа, являются процессы с применением шахтных печей и реторт периодического действия. Процессы с использованием вращающихся печей и твердого восстановителя находят промышленное применение, главным образом, при переработке металлургических отходов — пылей и шламов, которые содержат примеси цинка, свинца и др., а также комплексных железных руд (богатых титаном, хромом, никелем, марганцем и др.), не пригодных для использования в доменных печах. Процессы в кипящем слое получили меньшее распространение в связи с целым рядом специфических особенностей (жесткие требования к гранулометрическому составу, газодинамические ограничения существования кипящего слоя, температурные условия и др.).
Процессы металлизации в шахтных печах во многом похожи на процессы, протекающие в шахте доменных печей в области умеренных температур. Однако имеются и значительные отличия: в шахтной печи отсутствует кокс; важную роль в процессах восстановления оксидов железа играет водород; восстановительный газ является единственным источником тепла, обеспечивающим все тепловые потребности процесса.
В процессе восстановления окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии газа (твердого топлива), которые содержат водород. Водород легко восстанавливает железо:
F e 2 O 3 + 3 H 2 → 1000 ∘ C 2 F e + 3 H 2 O O_+3H_ C>> 2Fe+3H_O>>> ,
при этом не происходит загрязнения железа такими примесями как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде и в дальнейшем переплавляется в электрических печах. Для получения тонны железа прямым восстановлением из руды необходимо затратить примерно 1000 м3 водорода.
По своей сути процесс прямого восстановления железа является восстановлением железа из руд, минуя доменный процесс, то есть кокс в процессе не участвует.
Наиболее отработанным и широко распространенным процессом является процесс Midrex. С 1983 г. на Оскольском электрометаллургическом комбинате работают четыре модуля процесса металлизации Midrex общей мощностью 1700 тыс. т металлизованных окатышей в год. В состав каждого модуля входят: шахтная печь металлизации, реформер (реактор конверсии природного газа); система производства инертного газа; система аспирации. Система водного хозяйства, свеча, помещение пульта управления и электроснабжение являются общими для каждой пары модулей.
Шахтная печь для металлизации состоит из загрузочного (промежуточного) бункера; верхнего динамического затвора с загрузочным распределителем и загрузочными трубами; зоны восстановления; промежуточной зоны; зоны охлаждения; огнеупорной футеровки; постоянно действующих питателей; нижнего динамического затвора и маятникового питателя (для выгрузки готового продукта).
Продукты прямого восстановления
Губчатое железо
Губчатым железом называют продукт, который получают в результате восстановления железорудного материала без его плавления при температуре менее 1000—1200° С. В зависимости от вида исходного сырья губчатое железо представляет собой пористые куски восстановленной руды (редко агломерата) или окатыши, а в некоторых случаях — металлический порошок. Поскольку при восстановлении объемные изменения материала сравнительно невелики, плотность губчатого железа меньше плотности сырья, а пористость велика. Обычно кажущаяся плотность кускового губчатого железа 2—4 г/см3, а пористость 50—80 %.
В некоторых процессах восстановления мелкой руды, окалины или концентрата в неподвижном слое (например, в процессе Хоганес) происходит одновременное спекание исходного порошкового материала. Плотность образующегося брикета до некоторой степени зависит от температуры восстановления. Вследствие малой плотности губчатого железа насыпная масса его получается меньшей по сравнению с ломом, что приводит иногда к необходимости брикетирования (прессования) перед плавкой. Брикетирование проводят на прессах различного типа при удельных давлениях 1—3 тс/см2; при этом получают плотность брикетов до 5 г/см3.
Сильно развитая поверхность и высокая сообщающаяся пористость губчатого железа вызывают его повышенную окисляемость при хранении и транспортировке в неблагоприятных атмосферных условиях, хотя имеющиеся по этому вопросу данные противоречивы. Брикетирование уменьшает окисляемость.
Химический состав губчатого железа определяется в основном составом сырья. По сравнению с ломом оно значительно чище по содержанию примесей цветных металлов. Содержание пустой породы в нём выше, чем в исходной руде, пропорционально степени восстановления. Обычно сырьем служат богатые руды или концентраты, поэтому губчатое железо не подвергают дополнительной очистке и оно содержит все примеси пустой породы сырья. При получении губчатого железа из бедного сырья его подвергают обогащению магнитной сепарацией.
Губчатое железо используют для плавки стали (главным образом в электропечах), цементации меди (осаждения её из сернокислых растворов) и получения железного порошка.
Металлизованная шихта
Металлизованной шихтой называют частично восстановленное железорудное сырье, применяемое в доменной печи и в кислородных конвертерах для охлаждения плавки (взамен руды и лома). Степень восстановления металлизованной шихты обычно не превышает 80 %, в то время как для губчатого железа она чаще всего не бывает ниже 90 %.
Кричное железо
Кричное железо, производимое сейчас, отличается от той крицы, которую несколько веков назад получали в кричных горнах в виде больших кусков и проковывали непосредственно в изделия. Кричное железо в настоящее время производят в трубчатых вращающихся печах из бедных железных и железо-никелевых руд восстановлением их при 1100—1200 °С. Оно представляет собой довольно мелкие (крупностью 1—15 мм) металлические частицы с механическими примесями и включениями шлака. Количество шлаковых примесей в зависимости от схемы измельчения и магнитной сепарации промежуточного продукта составляет 10—25 %. При переработке хромо-никелевых руд получаемая крица содержит никель. Обычно крица имеет также высокое содержание фосфора и серы. Как правило, крицу используют в доменных печах, а в некоторых странах — в электропечах для выплавки стали или ферроникеля.
Чугун или углеродистый полупродукт
Чугун или углеродистый полупродукт получают во вращающихся печах или в электропечах, прямо связанных с печью восстановления, где восстановителем является твердое топливо. Чугун, полученный внедоменными методами, не отличается от обычного доменного; в ряде случаев получают полупродукт с меньшим содержанием некоторых примесей, чем в чугуне. Передел чугуна и полупродукта на сталь производится в известных сталеплавильных агрегатах без затруднений, а в случае полупродукта — с несколько меньшими затратами, чем передел доменного чугуна.
Реализованные на практике процессы и их агрегаты
Твёрдое восстановление
- Сырьё (Окисленные окатыши и кусковая руда) → Шахтные печи (Purofer, Midrex, Arex, Hyl III, Hyl ZR)
- Сырьё (Окисленные окатыши и кусковая руда) → Реторты (Hyl I)
- Сырьё (Рудная мелочь, отходы) → Реакторы с кипящим слоем (Fior, Finmet, Cincored, Spirex, Iron Carbide)
- Трубчатые печи (OSI, TDR, DRC,Ghaem, SL/RN, Jindal, Siil,Codir)
- Печи с вращающимся подом (Comet, Fastmet, Inmetco, Dry Iron, Iron Dinamics)
- Реактор с кипящим слоем (Circofer)
- Многоподовая вращающаяся печь (Primus)
- Процессы с плавильным генератором (Corex, Finex)
- Процессы в жидкой ванне (DIOS, Romelt (также известен как процесс ПЖВ), Hismelt, AusIron, Tecnored, AISI Direct, Ironmaking, CCF)
- Струйно-эмиссионные процессы (ИРСИД, БИСРА, СЭР)
- Доред, Krupp-Renn, Экеторп-Валлак, способ Буше, процесс в кипящем шлаковом слое Кавасаки, COIN
https://altenergetika.ru/obratimye-i-neobratimye-termodinamicheskie-proczessy/